Бериллий и магний.
62) Сходным по свойствам с основным ацетатом производным бериллия является его ацетилацетонат — !!!!. Он плавится при 108 °С и кипит без разложения при 270"С, почти нерастворим в воде, но хорошо растворяется в неполярных органических растворителях (СбНб, CSa и др.). Известен (но мало изучен) и ацетил- ацетонат магния.
63) Из циклопентадиенильных производных рассматриваемых элементов Ве(С5Н5)2 интересен своим строением: атом Be располагается между параллельными и отстояшими на 337 пм друг от друга плоскими кольцами C5H5 [с d(CC)= 143 н d(CH) = 110 пм], но на разных расстояниях от них [(ВеC) = 191 и 226 пм]. Возможно, что этой асимметрией и обусловлено наличие у Be(C5H5)2 дипольного момента !!!!. Сама она связана, вероятно, с ионным характером данного !!!! и малыми размерами Be2+, что создает возможность существования двух чётких минимумов на кривой его потенциальной энергии (при перемещении между кольцами).
Аналогичный по составу циклопентадиенил магния — Mg(C5H5)2 — может быть получен прямым действием паров циклопентадиена на нагретый металл. Он представляет собой бесцветное кристаллическое вещество (т. пл. 177, т. кип. 221 °С), очень чувствительное не только к воде и воздуху, но даже к углекислоте.
64) Для многих безводных солей бериллия и магния характерно легкое образование комплексных аммиакатов. При обычных температурах для них типичны составы [Be(NH3)4]X2 и [Mg(NH3)4]X2 (где X — одновалентный анион). Некоторые аммиакаты довольно устойчивы по отношению к нагреванию. Например, давление аммиака над [Be(NH3)4]Cl2 при 156 °С равно лишь 6 мм рт. ст., а над !!!! оно достигает атмосферного лишь при 227 °С. Интересен гидразиновый комплекс !!!!, в котором бериллий имеет, по-видимому, необычное для него координаанонное число 6. Вероятно, таково же оно и в устойчивом лишь при низких температурах (давление аммиака достигает 90 мм рт. ст. уже при -50°С) аммиакате BeCl2·!!!!. Водой все эти соединения разлагаются.
65) Из амидных производных Be и Mg были описаны Be(NH2)2, !!!! (где M — Na, К). Известен также амидобромид Mg(NH2)Br.
Лучше других изученный Mg(NH2)2 медленно выделяется при хранении голубого раствора магния в жидком аммиаке. Он представляет собой белый порошок, самовоспламеняющийся на воздухе и бурно разлагаемый водой. При нагревании в отсутствие воздуха происходит его разложение по схеме:
3Mg(NH2)2 = Mg3N2 + 4NH3.
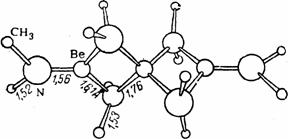
Из более сложных соединений того же типа интересен получаемый взаимодействием ВеН2 с диметиламином BeN(CH3)2, строение тримерной молекулы которого (образованной с участием донорно-акцепторных связей N-Be) показано на рис. .
66) Сульфиды бериллия и магния, а также аналогичные им селениды и теллуриды могут быть получены прямым синтезом из элементов. Производные бериллия с водой не взаимодействуют, тогда как производные магния более или менее гидролизуются. Для теплот образования из элементов даются значения (ккал/моль): 56 (BeS), 83 (MgS), 65 (MgSe) и 50 (MgTe). Удобным способом получения чистого бесцветного MgS является пропускание тока азота с примесью паров CS2
над нагретым до 800 °С оксидом магния. При 1200 °С подобным же образом реагирует с CS2 и окись бериллия. Для магния получены также полисульфиды MgS4 и MgS5.
67) Бесцветные нитриды Be и Mg могут быть получены непосредственным соединением элементов с азотом. В случае Be реакция быстро идет начиная с 900 °С, а в случае Mg — c 500 °С. Теплоты образования нитридов равны соответственно 140 и 111 ккал/моль. Оба они относятся к соединениям ионного типа (с радиусом !!!! около 140 пм). Нитрид бериллия Be3N2 очень твёрд, плавится лишь около 2200 °С (под давлением) и холодной водой почти не разлагается. Интересным путем его синтеза является протекающая при 700 °С реакция по уравнению:
3 Be + 2 KCN = Be3N2 + 2 C + 2 K.
Нитрид магния (Mg3N2) выше 700 °С начинает распадаться на элементы, при нагревании на воздухе сгорает до MgO, а водой тотчас разлагается на Mg(OH)2 и NH3. Известны также смешанные нитриды !!!! (где Э — Ве, Mg) и нитрофториды магния (!!!! MgaNF, MggNFg). Для аналогов Mg3N2 даются следующие значения теплот образования из элементов (ккал/моль): 128 (Мg3Р2), 96 (Mg3As2), 79 (Mg3Sb2) и 40 (Mg3Bi2). Фосфид состава Ве3Р2 известен и для бериллия.
68) Карбид бериллия состава Ве2С (т. пл. 2150 °С с разл.) образуется при накаливании ВеО с углем в электрической печи. Теплота его образования из элементов равна 22 ккал/моль. Судя по строению кристаллической решетки (обратный тип CaF2), карбид бериллия может рассматриваться как ионное соединение (Ве2+С4-). Водой он медленно разлагается с выделением метана. Образующийся при 450 °С по схеме
Смотрите также
Витамины и организм человека
Витамины – низкомолекулярные органические соединения различной
химической природы, необходимые для осуществления важнейших процессов,
протекающих в живом организме.
Для нормальной
жизнед ...
Введение.
XX в. насыщен многими событиями, которые
будоражили и потрясали земную цивилизацию. Шла борьба за передел мира, за
сферы экономического и политического влияния, за источники минерального сырь ...
