Бериллий и магний.
54) Для хорошо растворимого в воде ацетата магния характерен кристаллогидрат Mg(CH3COO)2·4H20 (т. пл. 65°С). Растворы этой соли проводят электрический ток в несколько раз хуже, чем то обычно для солей типа ЭХ2, а при высоких концентрациях становятся очень вязкими. И то и другое обусловлено, по-видимому, полимеризацией молекул Mg(CH3COO)2, протекающей с возникновением донорно-акцепторных связей O-Mg от карбонильного кислорода анионов.
55) Оксалат бериллия — ВеС2O4·3Н2O — является единственным оксалатом двухвалентного металла, хорошо растворимым в воде. Электропроводность его разбавленного раствора примерно в 5 раз меньше, чем у BeSO4, и почти не изменяется при повышении концентрации. Такое поведение соли согласуется с трактовкой структуры по типу Ве1Ве(С2O4)21·6Н20. Вместе с тем для константы диссоциации молекулы ВеС2О4 было найдено значение 6·10!!!!. Известны и комплексные оксалаты, например Na2[Be(C2O4)2]·H2O.
56) В отличие от бериллия, оксалат магния — MgC2O4·2Н2О — малорастворим воде (0,1 г/л). Для константы электролитической диссоциации этой соли значение 4·10!!!!. В растворе (NH4)2C2O4 она растворяется с образованием довольно устойчивого комплекса (NI-l*IMg*O*l. Вместе с тем раствор щавелевой кислоты способен растворять гораздо больше MgO, чем то соответствует реакции нейтрализации, что указывает на лёгкое образование хорошо растворимых основных оксалатов магния.
57) Для фосфата магния — Mg3(PO4)2 (т. пл. 1357 °С) — даётся значение ПР = 2·10!!!!, т. е. соль эта очень малорастворима в воде. Образованием кристаллического осадка MgNH4ЭO4 (где Э — Р или As) пользуются в аналитической химии для открытия иона Mg2+ с одной стороны, фосфорной и мышьяковой кислот — с другой. Реакция идет, например, по уравнению:
MgCl2 + NH4OH + Na2HPO4 = MgNH4PO4 + 2 NaCl + Н2О.
Фосфаты бериллия известны, но изучены хуже.
58) Боранаты бериллия и магния могут быть получены в эфирной среде по схеме:
ЭН2+В2Н6 = Э(ВН4)2.
Оба они представляют собой белые твёрдые вещества, растворимые в эфире и разлагаемые водой. Боранат бериллия летуч (т. возг. 91, разлагается выше 120 °С), тогда как боранат магния нелетуч (плавится в вакууме около 180 и разлагается лишь выше 260 °С). Молекула Ве(ВН4)2 полярна (m = 2,06). Данные трёх разных исследований её строения сильно расходятся, а Mg(BH4)3 имеет, вероятно, ионную структуру. Боранат бериллия мог бы, по-видимому, служить высококалорийной добавкой к реактивным топливам.
59) Алюмогидриды бериллия и магния были получены в эфирной среде по схеме:
ЭГ2 + 2 LiAlH4 = 2LiГ + 3 Э(AlH4)2
(где Г — С1, Вг). Они представляют собой белые твердые вещества, хорошо растворимые в эфире и разлагаемые водой. Строение их, вероятно, !!!! по типу Н2А1ННЭННА1Н2. Более устойчивый Mg(AlH4)2 термически разлагается (в отсутствие воздуха) лишь выше 140 °С.
60) Из других солей рассматриваемых элементов особенно интересны комплексные производные бериллия, в которых основным центральным атомом является кислород с координационным числом 4. Типичным представителем соединений этого типа является основной ацетат бериллия ОВе4(СН3СОО)6, получаемый взаимодействием его основного карбоната с безводной СНзСООН.
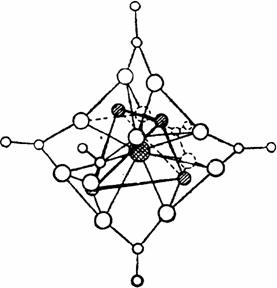
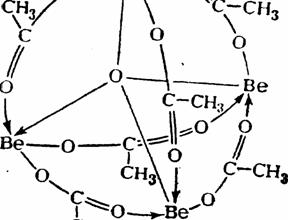
Рис. . Схема пространственного строения основного ацетата бериллия.
Рис. . Валентвая схема основного ацетата бериллия.
Как видно из рис. , центральный атом кислорода тетраэдрически окружён четырьмя атомами бериллия, а каждый из последних — четырьмя атомами кислорода. Помимо восьми обычных валентных связей в формировании молекулы участвуют 8 донорно-акцепторных связей О-Ве (рис. ). Получающаяся замкнутая структура так прочна, что кристаллизующийся в правильных октаэдрах основной ацетат бериллия не только плавится, но и кипит без разложения (т. пл. 285, т. кип. 331 °С). Это используется для очистки бериллия от примеси многих других элементов.
Основной ацетат нерастворим в воде, но растворяется в неполярных органических растворителях. Подобные ему производные бериллия известны и для некоторых других органических кислот. Вместе с тем, в отличие от Mg2+, А13+ и многих других катионов, Be2+ не имеет тенденции к комплексообразованию с “трилонами”. Обусловлено это, по-видимому, его очень малым радиусом.
61) Подобным основному ацетату неорганическим соединением бериллия является основной !!!!, который может быть получен термическим разложением Be(NO3)2 (в вакууме при 125 °С). Он представляет собой бесцветные летучие кристаллы, нерастворимые в неполярных органических растворителях. Известны и соли типа !!!! (где M-Na, К, NH4), строение аниона которых также аналогично основному ацетату бериллия. Для магния был выделен основной ацетат состава 4Mg(CH3COO)2·Mg(OH)2, при нагревании выше 200 °С разлагающийся до MgO.
Смотрите также
Сложные реакции
...
Сурьма
Сурьма (лат. Stibium), Sb, химический элемент V группы периодической системы Менделеева; атомный
номер 51, атомная масса 121,75; металл серебристо-белого цвета с синеватым
оттенка в природе ...
