Механизм действия и свойства амилаз
Субстратами для действия амилаз являются крахмал, состоящий из амилозы и амилопектина, продукты частичного гидролиза крахмала и гликоген.
Крахмал - растительный полисахарид с очень сложным строением. Это двухкомпонентное соединение, состоящее из 13-30% амилозы и 70-85% амилопектина. Оба компонента неоднородны, их молекулярная масса (М. м.) колеблется в широких пределах и зависит от природы крахмала. Амилоза - это неветвящийся полимер, в котором остатки глюкозы соединены a-1, 4-гликозидной связью; степень полимеризации около 2000. В «аномальных» амилозах с одной-двумя a-1, 6-связями полимеризация может возрасти до 6000 (рис.1). Амилоза практически не обладает восстанавливающей способностью, так как в каждой молекуле амилозы имеется только одна свободная альдегидная группа.
Молекула амилозы представляет собой растянутую спираль, шаг которой составляет 10,6 А и в каждый виток входит 3 остатка глюкозы. Максималь-
![]()
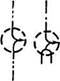
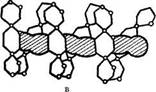
Рис 1. Строение амилозы:
а — амилоза без аномальных отклонений; б - схема возможных ветвлений амилозы; в — спираль амилозы в растворе с заключенными в ее полость молекулами йода.
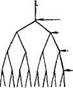
Концевые звенья с
альдегидными группами 1 разветвление
- 2 разветвления 4 разветвления 8 развет
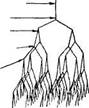
16 концевых звеньев
64 концевых
звена
Рис. 2.2. Амилопектин, схема дихотомического деления амилопектина (по К. Мейеру):
а - в плоскости; б - в пространстве.
ная длина молекулы амилозы достигает 7000 А. В растворе спираль сжимается за счет увеличения витка, в котором уже участвует 6 остатков глюкозы. При вхождении молекул йода в спираль амилозы возникает характерный синий цвет. Строго говорить о величине молекулы амилозы нельзя, т. е. даже из одного образца крахмала извлекается амилоза, с величиной молекулы от 500 до 2000 остатков глюкозы. Амилопектин имеет большую молекулярную массу, чем амилоза, и более сложное строение. Это ветвящийся полисахарид. Предполагается, амилопектин ветвится дихотомически, т. е. число концевых звеньев всегда на единицу больше числа звеньев, дающих ветвление, а сумма этих чисел дает общее число звеньев по всей цепи (см. рис. 2.2).
Механизм действия.
К группе амилотических ферментов относятся a- и b-амилазы, глюкоамилаза, пуллуланаза, изоамилаза и некоторые другие ферменты. Амилазы бывают двух типов: эндо- и экзоамилазы. Четко выраженной эндоамилазой является а-амилаза, способная к разрыву внутримолекулярных связей в высокополимерных цепях субстрата.
Глюкоамилаза и b-амилаза являются экзоамилазами, т. е. ферментами, атакующими субстрат с нередуцирующего конца.
При изучении механизма действия амилаз имеются определенные сложности, и прежде всего они заключаются в том, что субстрат - крахмал неоднороден и имеет различные характеристики по степени полимеризации гли-козидной цепи и количеству ветвлений.
Реакции, катализируемые амилазами, имеют две стадии: короткую -предстационарную и длительную - стационарную. Во время первой стадии эндоамилаза быстро уменьшает молекулярную массу субстрата, образуя смесь линейных и разветвленных олигосахаридов. Второй этап реакции продолжается, пока продукты гидролиза не перестанут окрашиваться йодом; он протекает значительно медленнее и зависит от индивидуальных свойств фермента и его природы. Поэтому конечные продукты гидролиза а-амилазами могут быть различными. Первая стадия воздействия фермента на субстрат хотя и носит неупорядоченный характер, имеет для всех видов a-амилаз схожий механизм.
Существует две гипотезы о механизме действия экзоамилаз на субстрат. Первая гипотеза предполагает, что, воздействуя на субстрат по одноцепочечному или «молниеобразному» механизму, экзоамилаза образует фермент-субстратный комплекс с захватом нередуцирующего конца цепи.
Дальнейшее продвижение фермента по этой цепи происходит до полного ее гидролиза. По второй гипотезе (b- и глюкоамилаза действуют на субстрат путем механизма множественной атаки, т. е. фермент образует комплекс с молекулой субстрата, затем через несколько этапов этот комплекс распадается и фермент связывается с новой молекулой субстрата. Иными словами, при множественной атаке происходит нечто среднее между неупорядоченным механизмом и одноцепочечной, «молниеобразной» атакой. Для полного гидролиза по этому механизму одна
молекула субстрата должна образовывать много раз фермент-субстратные комплексы. При этом возможен гидролиз нескольких связей в одном каталитическом акте.
Смотрите также
Бумага
...
Марганцево-цинковые элементы
...
Кефир
Кисломолочные продукты - это продукты,
вырабатываемые сквашиванием молока или сливок чистыми культурами молочнокислых
бактерий с добавлением или без добавления дрожжей или уксуснокислых бакт ...
