Элементы статистической термодинамики.
Qni=gni=2Ini+1.
Электронные суммы состояний содержат почти всегда лишь по одному фактору Больцмана,
а в качестве сомножителей и электронные вырожденности, так что это полное число входящих в него микросостояний, домноженное на фактор Больцмана с электронным термом:
Qei = gei´exp(-Ei min/kT)
Результат в виде стандартного химического сродства (приращения энергии Гиббса за пробег реакции) равен:
DrGo = -RTln Kp=-NAkT ln Kp=Sni×moi , откуда получается выражение логарифма константы равновесия. Это компактная форма
![Подпись: lnKp=Sini×{ln[(2pmikT)3/2(kT/Po)/h3]+ ln [Qri] + ln [QVi] + ln [Qei] + ln[gni]}](images/books/4505/image025.gif)
Потенцирование этого выражения даёт простейший результат:
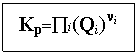
Любая термодинамическая функция состояния может быть получена из знакомых термодинамических потенциалов. В наших расчётах удобна свободная энергия:
A = -NkT×lnQ[(m, I1, I2, … n1,n 2, …)( T,V)].
p = -(¶A/¶V)T = NkT;
A ® A+pV = G ® m; Ao+NkT
¯
S(T,V)= - (¶A/¶T)V = - (¶G/¶T)p ;
¯
U(T) = A+TS ® CV = (¶U/¶T)V;
¯
H(T) =U+pV=U+NkT ® Cp = (¶H/¶T)V = CV + Nk .
Выполненные расчёты демонстрируют удивительные возможности, предоставляемые статистической термодинамикой. Формальная термодинамика таких возможностей не даёт .
Смотрите также
Регенерация азотной и серной кислоты
...
Серебро
...
Качественный анализ анионов
Цель аналитической химии - установление качественного и количественного
состава вещества или смеси веществ. В соответствии с этим аналитическая химия делится
на качественный и количественны ...
