Метод молекулярных орбиталей.
У атомов кислорода суммарное число орбиталей такое же, как у азота – 10, следовательно, молекулярных орбиталей у О2 – тоже десять. Суммарно количество электронов у молекулы О2 на два электрона больше, чем у молекулы азота. При распределении электронов по МО кислорода, в соответствии основным принципам распределения, последние два электрона занимают p2pyраз- и p2pzраз-орбитали, по одному на орбиталь (правило Гунда). Наличие неспаренных электронов на МО придает молекуле кислорода новые свойства, по сравнению с молекулой азота. Молекула кислорода становится парамагнитной, т.е. она приобретает магнитные свойства и способна притягивать магнитным полем. У диамагнитных веществ все электроны парные.
Рассмотрим кратность связи в молекуле кислорода. К.С.О2=10-6/2=2. По сравнению с молекулой азота, молекула кислорода должна быть менее прочной. Действительно это так. Энергия диссоциации молекулы кислорода составляет 494 кДж/моль.
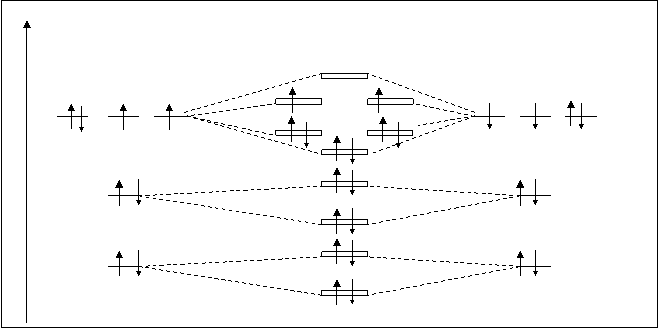 АО МО AO
АО МО AO
О’ O2 O’
s2pxсв
p2pyраз p2pzраз
p2pyсв p2pzсв
2P 2P
s2pxсв
s2sраз
2S 2S
s2sсв
s1sраз
1S 1S
s1sсв
Рис.4.24. Схема расположения молекулярных орбиталей O2.
Электронная формула молекулы кислорода:
2О=O2 [(s1sсв)2 (s1sраз)2 (s2sсв)2 (s2sраз)2 (s2pxсв) (p2py,zсв)4 (p2py,zраз)4].
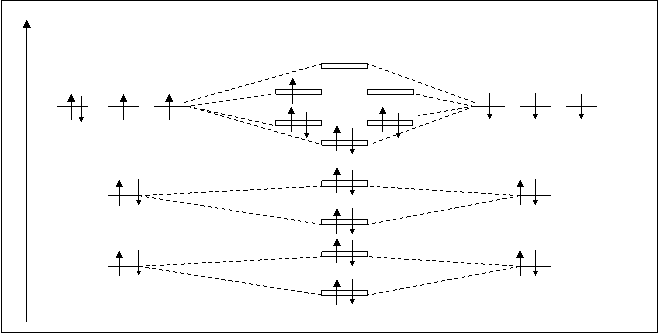 Рассмотрим молекулярную частицу, например молекулярный ион O+2. На рис.4.25. дана энергетическая схема такой частицы.
Рассмотрим молекулярную частицу, например молекулярный ион O+2. На рис.4.25. дана энергетическая схема такой частицы.
АО МО AO
О’ O+2 O+
s2pxраз
p2pyраз p2pzраз
p2pyсв p2pzсв
2P 2P
s2pxсв
s2sраз
2S s2sсв 2S
s1sраз
1S s1sсв 1S
Рис.4.25. Схема расположения молекулярных орбиталей частицы O+2.
В молекулярном ионе кислорода, частица O+2, суммированный заряд ядер кислорода на единицу превышает суммированный заряд электронной оболочки молекулы. Следовательно, у частицы O+2 на один электрон меньше, чем у молекулы кислорода O2. На схеме молекулярных орбиталей (рис.4.25.) на ppраз орбиталях имеется только один неспаренный электрон (орбиталь p2pyраз). Это вносит некоторые изменения в свойства таких частиц по сравнению с молекулами O2. По-видимому, ослабляют парамагнитные свойства и усиливают прочность молекулярного образования. Кратность связи O+2 будет (К.С. O2+=10-5/2=2,5) на 0,5 единиц выше. Следовательно такие кислородные частицы очень устойчивы. Энергия диссоциации O+2 равна 629 кДж/моль.
Сравнительные данные по распределению электронов на МО, кратности связи и энергии диссоциации молекул и некоторых молекулярных частиц элементов второго периода представлены в таблице 4.2.
Таблица 4.2.
|
Li2 |
Be2 |
B2 |
C2 |
N+2 |
N2 |
O+2 |
O2 |
O-2 |
O2-2 |
F2 |
Ne2 | |
|
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
ppyраз, ppzраз |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
|
ppyсв, ppzсв |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
— — |
|
spxсв |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
s2sраз |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
s2sсв |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
s1sраз |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
s1sсв |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
Кратность связи |
1 |
0 |
1 |
2 |
2,5 |
3 |
2,5 |
2 |
1,5 |
1 |
1 |
0 |
|
Длина связи, А |
2,67 |
— |
1,59 |
1,24 |
1,12 |
1,09 |
1,12 |
1,21 |
1,34 |
1,46 |
1,41 | |
|
Энергия диссоци-ации кДж/моль |
99 |
0 |
276 |
602 |
843 |
942 |
634 |
494 |
394 |
151 |
0 | |
|
Парамагнитные свойства |
+ |
+ |
+ |
+ |
Смотрите также
Нефть
...
Витамины В12 и В15
Витамины (от лат. Vita – жизнь) - группа органических соединений
разнообразной химической природы, необходимых для питания человека, животных и
других организмов в ничтожных количествах по с ...

 spxраз
spxраз