Метод молекулярных орбиталей.
Не’ Не2 Hе’’ энергетическая диаграмма молекулы Не2
ssраз содержит также два электрона на ssраз -
орбите, число электронов на связующей и
разрыхляющей орбиталях одинаково.
1S 1S Кратность связи молекулы равна нулю
(КСне2=2–2/2=0). Выигрыша энергии нет.
ssсв Следовательно, молекула Не2не существует.
Рис.4.21. Энергитическая схема Рассмотрим двухатомные молекулы
молекулы Не2. элементов второго периода.
У элементов второго периода, кроме 1S-орбиталей, в образовании МО принимают участие 2S-, 2Px-, 2Py-, и 2Pz-орбитали. Комбинация 2S-атомных орбиталей дает s2sсв-и s2sраз-орбитали. Взаимодействие 2p-орбиталей приводит к образованию двух типов МО-sрсв-, sрраз- и ppсв-, ppраз-орбиталей. s2pxсв-и s2pxраз-молекулярные орбитали образуются от 2Px-атомных орбиталей, вытянутых вдоль оси “x”, соединяющей центры объединяющихся атомов. Так как 2Py- и 2Pz-атомные орбитали расположены перпендикулярно этой оси, следовательно они образуют ppyсв-, ppyраз-, ppzсв- и ppzраз-орбитали, лежащие во взаимноперпендикулярных плоскостях. Форма p-молекулярных орбиталей показана на рис.4.20.
В соответствии со спекторскопическими данными молекулярные орбитали двухатомных молекул по уровню энергии располагаются в следующий ряд:
s1sсв <s1sраз <s2sсв <s2sраз <s2pxсв <p2pyсв =p2pzсв <p2pyраз =p2pzраз <s2pxраз.
Такой порядок расположения молекулярных орбиталей характерен для молекул второй половины периода (молекулы О2, F2, Nе2).
При энергетической близости 2S- и 2P-атомных орбиталей (В, С, N) электроны на s2s и s2р –орбиталях взаимно отталкиваются, поэтому p2pyсв и p2pzсв –молекулярные орбитали оказываются энергетически более выгодными, чем s2pxсв –МО. Порядок расположения молекулярных орбиталей несколько изменяется и имеет такую последовательность:
s1sсв <s1sраз <s2sсв <s2sраз <p2pyсв =p2pzсв <s2pxсв <p2pyраз =p2pzраз <s2pxраз.
Рассмотрим более подробно несколько молекул второго периода.
Молекула N2. Расположение молекулярных орбиталей представлено на рис.4.23.
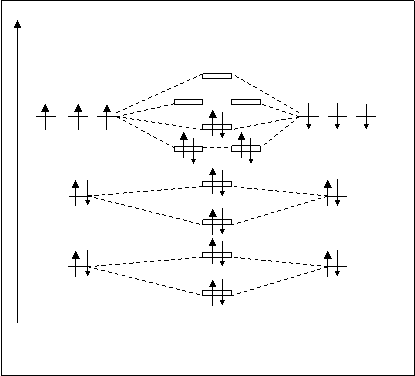 А.О. МО А.О. Электроны 1S-атомных ор-
А.О. МО А.О. Электроны 1S-атомных ор-
N’ N2 N’’ биталей азота образуют s1sсв -
spxраз и s1sраз -МО. Аналогично элек-
ppyраз ppzраз троны 2S-АО образуют s2sсв-
spxсв и s2sраз-МО. Электроны 2Р-
2P 2P подуровней азота при взаимо-
ppyсв ppzсв действии дают ppy,pzсв, spxсв и,
соответственно, такие же раз-
рыхляющие МО. В сумме оба
2S 2S атома азота имеют 10АО, на
s1sраз некоторых находится 14 элек-
тронов, молекулярных орбита-
1S 1S лей образуется тоже 10. На них
s1sсв должно разместиться 14 элек-
Рис.4.23. Схема расположения молекулярных тронов. Причем, заполнение
орбиталей молекулы N2. МО электронами происходит с
соблюдением трех известных принципов. В итоге, незаполненными остались p2pyраз-, p2pzраз- и s2pxраз-МО. Определим кратность связи молекулы N2. К.С.N2=10-4/2=3. Молекула с кратностью связи 3 очень прочная. Энергия диссоциации этой молекулы равна 940 кДж/моль. По сравнению с молекулой Н2 (для которой К.С.=1 и энергия диссоциации равна 435 кДж/моль) молекула азота сильно повысила свою прочность.
Электронная структура молекул, аналогична электронной структуре атома, может быть изображена при помощи электронных формул. В электронных формулах указываются все МО, заполненные электронами. Например, электронная формула молекулы Н2 имеет простой вид 2Н=Н2 [(s1sсв)2]. Электронная формула молекулы N2 более сложная: 2N=N2 [(s1sсв)2 (s1sраз)2 (s2sсв)2 (s2sраз)2 (ppy,pzсв)4 (spxсв)2].
Молекула О2. Атом кислорода располагается во второй половине периода, поэтому энергетическое различие между 2S- и 2Р-подуровнями больше, чем у атома азота, что не влечет ощутимое отталкивание 2S- и 2Р-электронов, поэтому последовательность в расположении МО не изменяется. Энергетическая схема орбиталей молекулы О2 показана на рис.4.24.
Смотрите также
Жидкие растворы
Растворы находят
широкое применение в самых различных областях практики. Категории растворов
относятся и природный раствор воды, и такие материалы, как сырая нефть и
различные нефтепродукты ...
Физико-химические свойства нефтей
...
Определение степени минерализации воды в реках г. Уссурийска
...
