Метод молекулярных орбиталей.
Многоатомные молекулы. В качестве примера рассмотрим молекулы СН4, NH3, CO2.
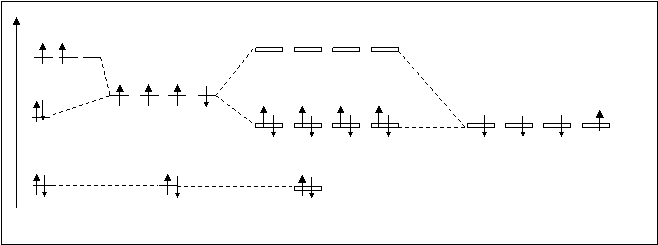
Молекула СН4. Выше было показано (4.3.1.), что атомные орбитали углерода в процессе взаимодействия с другими элементами (в частности с водородом) претерпевают перестройку, названную гибридизацией и в молекуле СН4 все связи идентичные и неразличимые. Эта особенность должна быть отражена и в методе молекулярных орбиталей. На схеме, приведенной на рисунке 4.28.,наряду с АО углерода показаны гибридные орбитали.
 Е А.О. А.О. МО А.О.
Е А.О. А.О. МО А.О.
С исходн. С гибр. СН4 4sхраз 4Н
2Р
4sхсв(или sсвs,x,y,z)
2SP3
1S
1S ss*
Рис.4.28. Схема расположения молекулярных орбиталей СН4.
1S-атомная орбиталь углерода, содержащая два электрона как орбиталь, лежащая в глубине атома, участие в образовании связи не принимает. Она без изменения переходит в молекулярную несвязывающую орбиталь. На рис.4.28. она обозначена ss*. В образовании МО принимает участие 8 атомных орбиталей (четыре от атома углерода и четыре от четырех атомов водорода). Следовательно, образуется 8 молекулярных орбиталей: 4 – связывающих и 4 – разрыхляющих. Заполняются электронами только все связывающие орбитали. Так как направление всех связей между атомом углерода и каждым из водородов совпадают с линией, связывающей центры атомов, и по прочности одинаковы, то все связывающие молекулярные орбитали находятся на одном и том же энергетическом уровне и обозначены одинаково sхсв. Аналогично и разрыхляющие. Электронная формула молекулы может быть записана так: СН4 [4*(sхсв)2].
Молекула NH3.
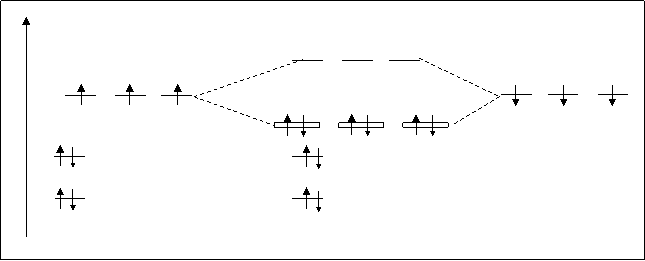 В отличие от СН4 в молекуле NH3 имеется еще одна несвязывающая орбиталь s2s*, т.к. 2s-атомная орбиталь азота практически не принимает участия в образовании связей. Схема расположения МО NH3 представлена на рис. 4.29.
В отличие от СН4 в молекуле NH3 имеется еще одна несвязывающая орбиталь s2s*, т.к. 2s-атомная орбиталь азота практически не принимает участия в образовании связей. Схема расположения МО NH3 представлена на рис. 4.29.
Е АО МО АО
N NH3 3H
sх,y,zраз
2P sх,y,zсв(или 3sхсв) 2P
2S s2s*
1S s1s*
Рис.4.29. Схема расположения МО в молекуле NH3 .
Электронная конфигурация молекулы NH3 :N+3H= NH3 [(ssсв)2(sy)2 (sz)2] или [3(sx)2].
Кратность связи в таких многоатомных молекулах определяется по известному принципу, но затем необходимо разделить на число связей. К.С. N-H=(6-0/2):3=1
Молекула СО2.
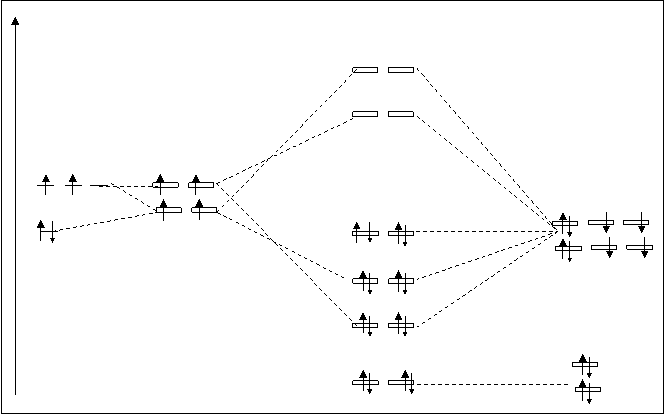 При взаимодействии углерода с кислородом атомные орбитали углерода претерпевают гибридизацию. На рисунке 4.30. показана схема расположения МО в молекуле СО2. На этой схеме не указаны 1s атомные орбитали углерода и обеих кислородов, т.к. они являются внутренними, во взаимодействие не вступают, остаются несвязывающими орбиталями.
При взаимодействии углерода с кислородом атомные орбитали углерода претерпевают гибридизацию. На рисунке 4.30. показана схема расположения МО в молекуле СО2. На этой схеме не указаны 1s атомные орбитали углерода и обеих кислородов, т.к. они являются внутренними, во взаимодействие не вступают, остаются несвязывающими орбиталями.
АО АО МО АО
С исходн. С*гибрид. СО2 2О
sхраз
py,zраз
2Pyz
2P 2Px,y,z
p*y,z
2S 2SPx
sхсв
pyсо,z 2S
ss*
Рис.4.30. Схема расположения МО в молекуле СО2.
Несвязующими становятся еще четыре орбитали. Они переходят в молекулу СО2 от двух атомов кислорода (две от 2s-атомных орбиталей и две от 2p-АО). Электронная структура молекулы может быть представлена следующей электронной формулой:
C+2O=СО2 [(ppy,zсв)4(ss,xсв) 4(p*py,z)4]. K.C.c-o=(8-0/2):2=2
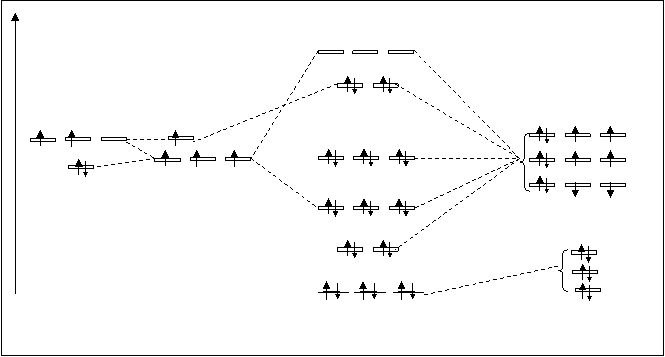 Ион СО22-. Схема молекулярных орбиталей в карбонат-ионе СО22-показана на рис.4.31.
Ион СО22-. Схема молекулярных орбиталей в карбонат-ионе СО22-показана на рис.4.31.
Е АО АО МО АО
С исход. С*гибрид. СО22- sхраз 3О
pzраз
2Px,y,z 2Pz
py*
2S 2Px,y,z
sхсв
pzсв
ss* 2S
Рис.4.31. Схема расположения МО в карбонат-ионе СО22-.
В карбонат-ионе несвязующими МО являются орбитали полученные от 2S-АО трех атомов кислорода (их три: ss*), а также три орбитали ppy*, полученные в результате превращения трех 2Р-атомных орбиталей кислорода. На МО карбонат-иона находятся два неспаренных электрона, расположенных на pz-разрыхляющих орбиталях. Электронная формула карбонат-иона следующая:
