5. Процессы. Второй закон термодинамики
δA′ max= (U1 – TS1 + PV1) – (U2 – TS2 + PV2) = G1 – G2 = – ΔG,
U – TS + pV = G,
A′ max= – ΔG.
Работа изобарно-изотермического процесса равна убыли изобарно-изотермического потенциала – физический смысл этой функции;
2) функция – полный дифференциал, однозначна, конечна, непрерывна.
G = U – TS + pV,
dG = dU – TdS – SdT + pdv + vdp,
dG = TdS – pdV – TdS – SdT + pdv + vdp,
dG = –SdT + Vdp, 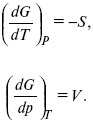
Повышение температуры приводит к тому, что изобарно-изотермический потенциал уменьшается, так как перед S стоит знак «минус». Повышение давления приводит к тому, что изобарно-изотермический потенциал увеличивается, так как перед V стоит знак «плюс»;
3) G как критерий направленности процесса в изолированной системе.
Для самопроизвольного процесса: (ΔG )P,T < 0. Для несамопроизвольного процесса: (ΔG )P,T > 0. Для равновесного процесса: ( ΔG)P,T = 0
ΔG(P,T)≤ 0.
Изобарно-изотермический потенциал в самопроизвольных процессах уменьшается, и, когда он достигает своего минимума, то наступает состояние равновесия. 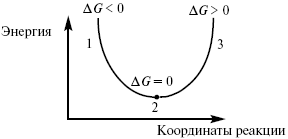
Рис. 5
где 1 – самопроизвольный процесс;
2 – равновесный процесс;
3 – несамопроизвольный процесс.
Совершается работа за счет ΔU и ΔH .
Противодействующие факторы.
Энтальпийный фактор характеризует силу притяжения молекул. Энтропийный фактор характеризует стремление к разъединению молекул.
Энтальпия – Н Внутренняя энергия – U.
H = U + PV,
dH = dU + pdv + vdp,
U = TS – PV,
dU = TdS – SdT + pdV + Vdp,
dH = –pdV + pdV + Vdp; U = TdS + VdP. 
Рис. 6
где 1 – самопроизвольный процесс,
2 – несамопроизвольный процесс,
3 – равновесный процесс,
(dH)P,T ≤ 0,
(dU)S,T ≤ 0.
Уравнения Гиббса – Гельмгольца – уравнения максимальной работы
.
Они позволяют установить связь между максимальной работой равновесного процесса и теплотой неравновесного процесса 
уравнение Гельмгольца (уравнение связывающее функции F и G с их температурными производными). 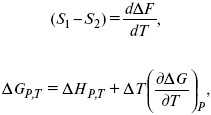
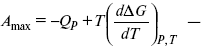
уравнение Гиббса (уравнение связывающее функции F и G с их температурными производными).
Уравнения эти дают возможность рассчитать работу через температурный коэффициент функции Гельмгольца или через температурный коэффициент функции Гиббса.
Уравнение Клаузиуса-Клапейрона
Оно позволяет применить второй закон термодинамики к фазовым переходам. Если рассчитать процессы, в которых совершается только работа расширения, то тогда изменение внутренней энергии
U2 – U1 = T(S2 – S1) – P(V2 – V1),
(U1 – TS1 + PV1) = (U2 – TS2 + PV2),
G1 = G2 – в условиях равновесия.
Предположим, что 1 моль вещества переходит из первой фазы во вторую.
I фаза =>
dG1 = V1dp – S1dT.
II фаза =>
dG2= V2dp – S2dT, при равновесии dG2 – dG1 = 0
dG2 – dG1 = dp(V2 – V1) – dT(S2 – S1) –
нет условного равновесия, 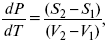
где dP/dT – температурный коэффициент давления, 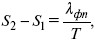
где λ фп – теплота фазового перехода. 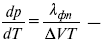
Смотрите также
Электрохимические методы защиты металлов от коррозии
...
Оксисоединения
Под оксисоединениями
понимают органические соединения содержащие в составе своей структурной формулы
одну или несколько гидроксильных групп (OH). Таковыми являются все спирты и
фенолы.
...
