Методы расчета энергии активации и предэкспоненциального множителя
В большинстве случаев для расчета энергии активации Еа по экспериментальным данным используют интегральную форму уравнения Вант-Гоффа-Аррениуса (6) или его запись в виде:
lgK = lgKo - Е а/2,303 RT (9)
Следовательно, lgK линейно зависит от обратной абсолютной температуры (см. рисунок)
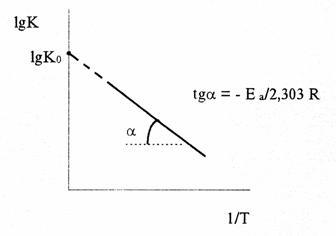
Значение Еа находят по тангенсу угла наклона прямой, проходящей через экспериментальные точки: Е а= -2,303Rtgα.
Предэкспоненциальный множитель К0 определяется отрезком, отсекаемым продолжением прямой на оси ординат при 1/Т = 0.
Если имеются значения константы скорости химической реакции при двух температурах, то из уравнения (9) можно получить:
Еа =(2,303RT1T2 lgK2 /K1 )/(T2-T1) (10)
Энергия активации Еа имеет размерность энергия/моль и измеряется в единицах Дж/моль. Размерность К0 совпадает с размерностью константы скорости. Теория и экспериментальные данные (для широкого температурного интервала) показывают, что Еа и К зависят от температуры. Однако эту зависимость можно не учитывать, если реакции исследуются в достаточно узком температурном интервале.
Изложенный выше метод расчета Еа предполагает, что константы скорости реакций при различных температурах известны.
Однако, есть способ расчета Еа, так называемый метод трансформации, который не требует знания K=f(T).
Пусть при температурах T1 и T2 в смесях одного и того же начального состава протекает химическая реакция. Если к моментам времени τ1 и τ2 реакция прошла на одну и ту же глубину, то есть изменения концентраций исходных веществ или продуктов реакции одинаковы, то отношение скоростей реакции равно:
W1 / W2 = (dC/d τ1 ) /(dC/d τ2) = d τ2 / d τ1. (11)
Заменим в уравнении (11) скорости реакций при заданных температурах соотношением (4)
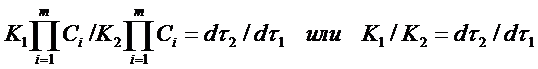
. (11а)
Таким образом, отношение K1 /K2 можно заменить отношением τ1 / τ2
Подставим в отношение (11а) значения констант скорости при температурах T1 и Т2, используя уравнение Аррениуса (5):
K0exp(-Ea/RT1)/ K0exp(-Ea/RT2) = d τ2 / d τ1.
Полагая, что для узкого температурного интервала К0 и Еа= const находим
ехр[-Ea/R(l/T1 - 1/Т2)] = d τ2 / d τ1. (12)
Разделение переменных и интегрирование дают:
ехр[-Еа(Т2 – T1 )/RT1 T2 ] = τ2 / τ1. (13)
Следовательно, при заданных T1 и Т2 отношение τ2 / τ1 для реакций, протекающих на одну и ту же глубину, постоянно и называется коэффициентом трансформации. Если этот коэффициент известен, то значение энергии активации рассчитывается по формуле:
Еа = R[T1 T2 /(Т2 – T1)]-ln(τ2 / τ1). (14)
Смотрите также
Карбоновые кислоты. Уксусная кислота
...
Каучук, строение, свойства, виды и применение в профессии коммерсанта
Я выбрала тему “Каучук”, так как она тесно
связана с моей профессией “Коммерсант”. Много непродовольственных товаров
изготовлено на основе синтетического каучука: Обувные товары, игрушки, сп ...
