Числа переноса.
Переносчиками тока в растворах электролитов служат ионы, но так как абсолютные скорости движения анионов и катионов в данном растворе неодинаковы, то большую долю тока всегда переносят более быстрые ионы. Величину, при помощи которой можно выразить долю электричества, переносимого ионами данного вида, называют числом переноса; для катионов оно обозначается через t+, для анионов — через t-. Количество электричества Q, перенесенное ионами i-гo вида через данное сечение раствора электролита, определяется по уравнению
Q=ziFciui sτ , (36)
где zi - валентность; ci -концентрация, моль/м3; ui — абсолютная скорость ионoв i-го вида, м2
·с-1·В-1; s — площадь сечения, м2; τ— время, с. Число переноса ti определяется соотношением
, (37)
где Q — количество электричества, перенесенное всеми нонами. На основании формулы (37) можно сказать, что число переноса иона — это доля электричества, перенесенная ионами данного вида. В частности, для раствора сильного электролита вместо уравнения (37) можем написать
; (38)
Подставляя выражение (36) в (38) и учитывая условие электронейтральности z+c+=z-c-, получаем
; (39)
При этом
t+ + t- = 1 (40)
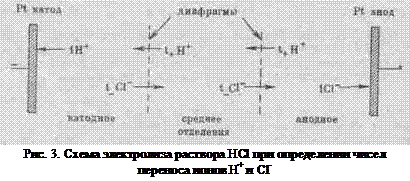
Различие в скоростях движения анионов и катионов приводит к тому, что они переносят разные количества электричества, но это не влечет за собой нарушения электронейтральности раствора, а лишь изменяет концентрацию электролита у катода и анода. Связь между числами переноса, подвижностями ионов и изменением содержания электролита в катодном и анодном отделениях можно установить, составив материальный баланс процесса электролиза. На рис.3 приведена схема электролиза соляной кислоты. Электродами служат пластинки из инертного металла (платины). Пространство между электродами разделено двумя пористыми диафрагмами на три отделения:
катодное, среднее и анодное. Если пропустить через раствор 1 фарадей электричества, то по закону Фарадея на электродах выделится по 1 г/моль водорода и хлора:
(на катоде) H+ + ē → ½ H2 (г) (41)
(на аноде) Cl- → ½ Cl2 (г) + ē (42)
При этом через раствор пройдет t+ г/моль катионов (ионов водорода) от анода к катоду и t- г/моль анионов (ионов хлора) от катода к аноду. Катионы перенесут через данное поперечное сечение раствора электролита t+ фарадеев электричества от анода к катоду, а анионы перенесут в обратном направлении t- фарадеев. Всего катионы и анионы перенесут через поперечное сечение электролита t+ + t- = 1фарадей, или F Кл электричества.
В катодном отделении на катоде из раствора выделяется 1 г/моль ионов водорода. Из среднего отделения через диафрагму поступает в катодное отделение t+ г/моль ионов водорода (t+H+) и из катодного отделения в среднее отделение уходит t- г/моль ионов хлора (t-Cl-). В результате получаем материальный баланс ионов H+и Cl- (в г/моль) в катодном отделении:
-1H+ + t+H+ - t-Cl- = -(1-t+)H+ - t-Cl- (43)
Учитывая соотношение (40), получаем
-t- H+ - t-Cl- или - t- НС1 (44)
 Таким образом, в результате протекания через электролизер одного фарадея электричества содержание НС1 в катодном отделении уменьшилось на t- г/моль.
Таким образом, в результате протекания через электролизер одного фарадея электричества содержание НС1 в катодном отделении уменьшилось на t- г/моль.
В анодном отделении на аноде из раствора выделяется 1 г/моль ионов Cl-. Из среднего отделения в анодное отделение поступает t- г/моль ионов Cl- и из анодного отделения в среднее уходит t+ г/моль
H+ . В результате получим материальный баланс ионов H+ и Cl- в анодном отделении:
-t+H+ - 1Cl- +t-Cl- =
-t+H+ - (1 - t- ) Cl- (45)
или -t+H+ - t+Cl- , или –t+HCl.
Из этого материального баланса видно, что в результате протекания через электролизер одного фарадея электричества содержание НС1 в анодном отделении уменьшилось на t+ г/моль.
В среднем отделении электролизера содержание НС1 не изменится, так как через обе диафрагмы проходит одинаковое число г/моль ионов Н+ в одном направлении и соответственно ионов С1- в другом направлении:
-t+H+ + t+H+ + t-Cl- - t-Cl- = 0 (46)
Если при пропускании через электролизер Q кулонов электричества содержание НС1 в катодном отделении уменьшилось на Δnк моль-экв и в анодном отделении на Δnа моль-экв, то будут справедливы соотношения
;
;
(47)
Таким образом, по изменению содержания электролита в катодном и анодном отделениях при электролизе можно определить числа переноса ионов. Этот способ определения чисел переноса называется способом Гитторфа.
Уравнение (47) справедливо, когда катион и анион электролита выделяются на электродах из инертного материала.
При электролизе раствора сульфата меди (II) с медными электродами на катоде разряжается ион меди:
Смотрите также
Оксисоединения
Под оксисоединениями
понимают органические соединения содержащие в составе своей структурной формулы
одну или несколько гидроксильных групп (OH). Таковыми являются все спирты и
фенолы.
...
Ангидриды карбоновых кислот. Кетены. Нитрилы
...
Металлы в алхимии
Слово «алхимия» воскрешает в памяти
известную средневековую гравюру, изображающую старца, который трудится в своей
лаборатории среди множества инструментов, один таинственней другого, одержи ...
