Цинк и его свойства
Интересно отметить, что меняя условия образования комплексов, и прежде всего кислотность среды, нередко удается наблюдать взаимное превращения комплексов внедрения («аммиакаты») в комплексы типа «аммонийных солей» и обратно.
Гидразингидраты состава ![]() ,
, ![]() обладают значительной прочностью из растворов комплексов сероводород не осаждает сульфид цинка. Первый из них плохо растворяется в воде, не растворим в спирте.
обладают значительной прочностью из растворов комплексов сероводород не осаждает сульфид цинка. Первый из них плохо растворяется в воде, не растворим в спирте.
8. Напишите уравнения реакций гидролиза соли ![]() по 1-ой стадии в молекулярном и ионном виде с учетом всех равновесий. Рассчитайте рН среды при гидролизе этой соли (0,01 моль/л). Как усилить гидролиз?
по 1-ой стадии в молекулярном и ионном виде с учетом всех равновесий. Рассчитайте рН среды при гидролизе этой соли (0,01 моль/л). Как усилить гидролиз?
Решение.
Соли цинка легко гидролизируются.
Рассмотрим гидролиз нитрата цинка.
![]()
В результате гидролиза нитрата цинка мы получим основную соль, основной нитрат цинка![]() .
.
![]()
![]()
![]()
При гидролизе указанной соли мы получим ионы ![]() , тогда РН < 7. Раствор будет иметь кислую реакцию.
, тогда РН < 7. Раствор будет иметь кислую реакцию.
Рассчитаем РН среды.
![]()
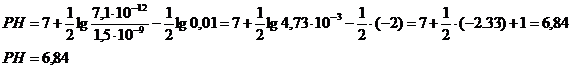
Повлиять на процесс гидролиза можно с помощью добавки реактивов, кислот или основ. В процессе гидролиза мы получаем ионы Н+, если их связать действием ионов ОН- , то процесс гидролиза усилится. Поскольку гидролиз процесс равновесный, то уменьшение концентрации ионов Н+ из – за реакции:![]() приведет к смещению равновесия вправо, к усилению гидролиза.
приведет к смещению равновесия вправо, к усилению гидролиза.
Ослабить гидролиз можно введение ионов Н+, что приведет к смещению равновесия влево.
9. Окислительно-восстановительные реакции.
9.1. Дайте оценку восстановительных свойств Zn и окислительно-восстановительных свойств его ионов в зависимости от его рН среды (используйте справочные характеристики).
Решение.
Цинк – сильный восстановитель. На реакции цинка и ионами меди основана работа химического элемента Даниеля. Нормальный электродный потенциал цинка - 0.7618 В. как восстановитель цинк используют в многих химических процессах, например, он используется при восстановлении органических веществ, и т.п.
Восстановительная активность цинка проявляется особенно активно при РН<7, в кислых растворах. Он восстанавливает водород из кислот, например разбавленной серной или соляной.
![]()
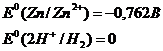
Также цинк может восстанавливать металлы менее активные чем он сам в нейтральной среде. Он восстанавливает металлы от хрома (-0,74 В) до серебра (0,79 В). Это его свойство часто используют для изготовления гальванических элементов.
![]()
Смотрите также
Химическая термодинамика
Химическая термодинамика – наука, изучающая условия
устойчивости систем и законы.
Термодинамика – наука о макросистемах.
Она позволяет apriori определить принципиальную
невозможность того или и ...
Эксплуатационные свойства судового маловязкого и тяжелых моторных
топлив
Настоящий
раздел содержит краткую характеристику лабораторных методов, разработанных в
ЦНИИ морского флота (г. Санкт-Петербург) и позволяющих проводить сравнительную
оценку опытных и эталонных об ...
Химия меди
Медь (лат. Cuprum) - химический элемент.
Один из семи металлов, известных с глубокой древности. По некоторым
археологическим данным - медь была хорошо известна египтянам еще за 4000 лет ...
