Подгруппа селена.
Соли теллуровой кислоты удобно получать сплавлением теллуритов с КNО3 (нормальные соли состава М2ТеО3 при 450 °С окисляются уже кислородом воздуха).
Наиболее обычными теллуратами являются довольно малорастворимый Nа2Н4ТеО6 и легкорастворимый К2Н4ТеО6·3Н2О. Шестизамещенная соль натрия (Nа6ТеО6) может быть получена сплавлением Н6ТеО6 с NаОН. На воздухе она постепенно переходит в Nа2H4ТеО6·3Н2О. По данным рентгеноструктурного анализа Нg3ТеО6, ион ТеО66- имеет структуру октаэдра с d(ТеО) = 198 пм.
При нагревании Н6ТеО6 в запаянной трубке до 140 °С образуется аллотеллуровая
кислота — вязкая жидкость, полностью смешивающаяся с водой и обладающая ясно выраженными кислотными свойствами. Она представляет собой, по-видимому, раствор смеси полимерных теллуровых кислот. При хранении водного раствора аллотеллуровая кислота постепенно переходит обратно в Н6ТеО6.
Отвечающий селеновой кислоте ангидрид — триоксид селена SeO3 представляет собой бесцветное кристаллическое вещество, хорошо растворимое в воде с образованием селеновой кислоты. Напротив, жёлтый триоксид теллура (TeO3) в воде почти нерастворим. Однако концентрированные растворы сильных щелочей растворяют его с образованием соответствующих теллуратов.
Триоксид селена (т. пл. 121 °С) удобно получать по схеме:
К2SеО4 + SO3 = К2SO4 + SеО3
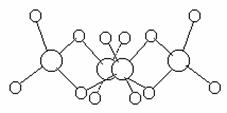
Теплота его образования из элементов равна 171 кДж/моль. Основной молекулярной формой этого вещества для всех агрегатных состояний является тетрамер (SеО3)4 (рис. 4), в котором атомы селена [d(SеSе) = 313 пм соединены друг с другом кислородными мостиками (d(SеО) = 180 пм] и имеют по два “собственных” атома кислорода [d(SеО) = 156 пм]. В парах присутствуют и мономерные молекулы SеО3 (при 120 °C порядка 25 %) с d(SеО) = 169 пм. Расплавленный селентриоксид весьма склонен к переохлаждению, а твердый известен в двух формах (из которых одна нестабильна). Выше 180 °С он разлагается на SеО2 и кислород, но в вакууме может быть возогнан без разложения.
|
Рис. 4. Схема строения (SeO3)4. |
Cелентриоксид обладает настолько сильными окислительными свойствами, что окиcляет НСl до свободного хлора даже при охлаждении. Однако из раствора в жидкой SO2 он может быть выделен без изменения. Избытком серы SеО3 восстанавливается до элементарного селена, а при взаимодействии его с селеном или теллуром образуются зеленые вещества, по-видимому, аналогичные S2O3.
При растворении SеО3 в Н2SеO4 образуются более или менее нестойкие пирокислоты селена — Н2Sе2О7 (т. пл. 19 °С), Н4Sе3О11 (т. пл. 25 °С с разл.).
Триоксид теллура может быть получена обезвоживанием теллуровой кислоты при 300-350 °С. Образующаяся при этом желтая ТеО3 аморфна и крайне малорастворима в холодной воде (примерно 0,5 г/л). Соляную кислоту ТеО3 окисляет лишь при нагревании (в отличие от SеО3).
Длительным выдерживанием ТеО3 при 406 °С был получен светло-желтый оксид состава Те2О5, переходящий в ТеО2 лишь при 485 °С. Он плохо растворим в воде но хорошо растворяется в крепком растворе КОН. Данные магнитного исследования говорят за то, что этот оксид является производным пятивалентного теллура.
Смотрите также
Синтез замещенных пирролов
Пятичленные
гетероциклические структуры, такие как пиррол, а также сопряженные молекулы,
содержащие пиррольные фрагменты потенциально важны в качестве оптических
электроактивных материалов. ...
Амиды
Амидами называют производные кислот,
в которых гидроксильная группа заменена на аминогруппу. Амиды можно
рассматривать также как ацильные производные аминов. По номенклатуре IUPAC названия
...
Белки, их строение и состав
БЕЛКИ — это азотсодержащие
высокомолекулярные органические вещества со сложным составом и строением молекул.
Белок можно
рассматривать как сложный полимер аминокислот.
Белки входят в
...