Спектральные методы анализа
Это - общая закономерность, поэтому спектральный анализ можно проводить как по спектру испускания, так и по спектру поглощения. Первый способ удобен для анализа материалов, в которых легко возбуждается спектр испускания составляющих веществ, например металлов и газов, а второй - более удобен при анализе материалов, в которых трудно вызвать возбуждение составляющих веществ (например, растворы).
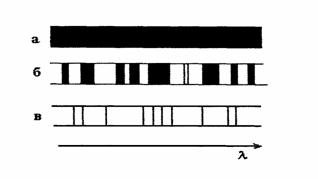
Эмиссионные спектры делятся на сплошные, полосатые, линейчатые (рис.2.2.3). Сплошные (или непрерывные) спектры содержат все длины волн в определённом интервале.
|
|
жидкие или твёрдые тела. Полосатые спектры возникают при излучении ионизированных и неионизированных молекул, состоящих из двух и более атомов, если эти молекулы удалены друг от друга настолько, что не взаимодействуют с соседними молекулами. Линейчатые спектры испускают атомы или ионы, |
Их испускают раскалённые которые находятся на таких расстояниях друг от друга, что их излучение можно считать независимым. Газы и пары металлов имеют линейчатые спектры.
Линии в спектрах атомов расположены не беспорядочно, а объединяются в группы, называемые сериями. Расстояния между линиями в серии закономерно убывают по мере перехода от более длинных волн к более коротким.
Бальмеером для простейшего линейчатого спектра водорода было обнаружено, что частоты спектральных линий в сериях, расположенных в различных областях электромагнитного излучения, находятся в определённой закономерной связи друг с другом, которую в общем виде для всех элементов выразили зависимостью
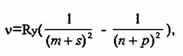
или в определённых случаях
![]()
где - частота, соответствующая каждой из рассматриваемых линий; Ry - постоянная Ридберга, равная 3,2898·1015 Гц;
m и n - целые числа (m - постоянное для каждой отдельной серии, а n - переменное);
s, p, d, f - малые десятичные дроби порядка 0,1…0,6.
Таким образом, частота любой спектральной линии может быть представлена разностью двух членов:
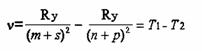
называемых спектральными термами или просто термами (от латинского terminus - пограничный знак). Оказалось, что различные термы могут попарно комбинироваться, давая начало новым сериям. Однако не все термы могут таким образом комбинироваться. Ограничения на комбинирование регламентируются правами отбора.
Физический смысл терма становится ясен, если умножить левую и правую части уравнения для на постоянную Планка h (равную 6,626 10-34 Дж с). Тогда левая часть уравнения h - энергия фотона, а правая - разность энергий. Следовательно, члены уравнения hТ1 и hТ2 - есть не что иное, как разность энергий энергетических уровней атома, получившего фотон при переходе из одного энергетического состояния в другое.
Любая серия спектральных линий обусловлена переходом электронов из ряда высших энергетических уровней на один определённый более низкий уровень (постоянный терм, первый член в правой части уравнения). Индивидуальные особенности атомов элементов, проявляющиеся в их спектрах, сказываются в поправочных членах серийных формул - s, p, d, f.
Атом каждого элемента характеризуется определённой системой энергетических уровней и, следовательно, определённым набором спектральных линий в спектре испускания. Поэтому спектры атомов могут быть использованы для их распознавания, т.е. Для качественного анализа.
Помимо величины длины волны спектральная линия имеет ещё одну важную характеристику - интенсивность. Интенсивность спектра испускания (эмиссии) связана с энергией, испускаемой возбуждёнными атомами или молекулами вещества.
Интенсивности спектров зависят от вероятностей переходов, от заселённости уровней, начальных для этих переходов.
Для спектров испускания величину интенсивности () спектральной линии можно представить в виде
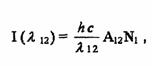
где 12 - длина волны спектральной линии, соответствующей переходу из состояния (1) в состояние (2);
А12 - коэффициент Энштейна, определяющий вероятность перехода из состояния (1) в состояние (2) с испусканием фотона;
N1 - число атомов или молекул в состоянии (1).
Из формулы следует связь интенсивности линии с числом возбуждённых атомов или молекул. Чем больше число возбуждённых атомов (молекул), тем больше интенсивность спектральной линии. Поэтому, измеряя интенсивность спектральной линии, можно определить число возбуждённых атомов (молекул), т.е. решить задачу количественного анализа.
Смотрите также
Возможная схема этапов оптимизации ХТС
Процессы
химической технологии это сложные физико-химические процессы, протекающие как в
пространстве, так и во времени. В них участвуют потоки энергии (тепло и холод)
и многофазные и много ...
Подгруппа углерода. Углерод
...
Полимеры
...