Спектральные методы анализа
В результате изменения энергии атома или молекулы они переходят из основного состояния с минимально возможной внутренней энергией Е0 в возбужденное состояние с энергией Е1. Внутренняя энергия является величиной дискретной (квантовой), поэтому переход атома или молекулы из основного состояния в другое всегда сопровождается скачкообразным изменением энергии, т.е. получением или отдачей порции (кванта) энергии.
Квантами электромагнитного излучения являются фотоны, энергия которых связана с частотой и длиной волны излучения известным соотношением
Е = h · = ![]() ,
,
где Е = Е1 - Е2, Е1 - энергия начального, а Е2 - энергия конечного состояния атома или молекулы, между которыми происходит переход; h - постоянная Планка; с - скорость света; - частота; - длина волны электромагнитного излучения.
При возбуждении атома происходит перемещение электронов с внешних заполненных уровней на незаполненные более высокие энергетические уровни.
В возбуждённом состоянии атом не может долго находиться. Он стремится отдать полученную избыточную энергию и возвратиться в невозбуждённое состояние. Через очень короткое время (10-8 - 10-7с) атом самопроизвольно возвращается из возбуждённого состояния в основное или промежуточное.
При переходе электрона с верхнего уровня на нижний выделяется фотон - квант излучения с определёнными и .
Схематично электронные переходы в атомах между различными состояниями, сопровождающиеся испусканием и поглощением квантов электромагнитного излучения, можно представить в виде схемы (рис.2.2.1).
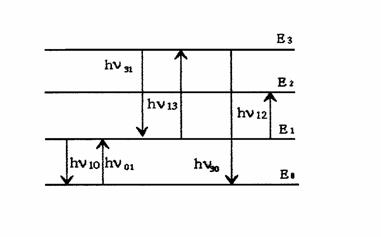
Горизонтальными линиями на рис.2.2.1. изображены уровни энергии различных состояний атома. Уровень Е0 это уровень основного состояния; Е1, Е2, Е3 - уровни возбуждённых состояний в порядке возрастания их энергии. Вертикальные стрелки соответствуют испусканию (стрелка вниз) или поглощению () фотона. Очевидно, что
01 = 10, 13 = 31 и т.д.
Совокупность фотонов, испускаемых или поглощаемых при каком - либо одном электронном переходе атома, создающая излучение с одной длиной волны, называется спектральной линией. Длина волны спектральной линии может быть определена из соотношения = ![]() . Совокупность спектральных линий, относящихся к определённому атому (молекуле), образует спектр данного атома (молекулы).
. Совокупность спектральных линий, относящихся к определённому атому (молекуле), образует спектр данного атома (молекулы).
Спектр, обусловленный переходом при Е1 Е2, называется спектром испускания, а при Е1 Е2 - спектром поглощения. Переходы и соответствующие спектральные линии, проходящие с основного энергетического уровня или на него, называются резонансными.
Для возбуждения спектральной линии необходима определённая энергия, называемая потенциалом возбуждения. Если сообщить атому слишком большую энергию, то может произойти полное удаление электрона, т.е. ионизация атома. Необходимая для этого энергия называется потенциалом ионизации. Резонансные линии самые яркие и характеризуются наименьшим потенциалом возбуждения.
Изменение энергии молекулы сопровождается изменением как энергии колебаний и вращений, т.е. у молекулы нет чисто электронных переходов, а возможны только электронно-колебательно-вращатель-ные (ЭКВ) переходы. Число возможных ЭКВ переходов у молекулы значительно больше, чем у атомов, поэтому, как правило, спектры молекул сложнее и состоят из большего числа спектральных линий в оптическом диапазоне длин волн. Принципиальную схему энергетических уровней молекулы можно представить следующим образом (рис.2.2.2).
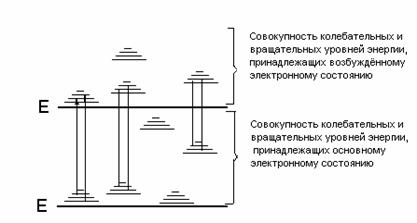
Рис.2.2.2. Схема энергетических уровней молекулы
Как для молекул, так и для атомов проявляются не все мыслимые переходы. Переходы регламентируются так называемыми правилами отбора: разрешенными являются переходы, при которых квантовое число меняется на единицу (например, S p, p d и т.д.).
Для аналитических целей можно использовать как эмиссионные, так и абсорбционные спектры, поскольку они взаимосвязаны. Например, свет, излучаемый раскалёнными парами металлического натрия, пропущенный через призму, даёт две очень близкие желтые линии с длинами волн 589,0 и 589,6 мкм. Это так называемые D - линии натрия. С другой стороны, если пропускать полихроматический белый свет (т.е. Совокупность пучков света со всеми длинами волн) через пары натрия, а затем разложить его на составляющие цвета в стеклянной призме, то на фоне непрерывного спектра будут обнаружены две чёрные линии как раз на месте D - линий. Следовательно, пары натрия поглощают излучение именно с теми длинами волн, какие они испускают при возбуждении.
Смотрите также
Технология неконцентрированной азотной кислоты
Азотная
кислота по объему производства занимает среди других кислот второе место после
серной кислоты. Все возрастающий объем производства HNO3
объясняется огромным значением азотной кислот ...
Газохроматографическое исследование углеводородов С1-С6 сероводорода и меркаптанов в нефтяных продуктах
Нефть является основным сырьем для производства
энергоносителей, которые играют ведущую роль в современной экономике. Масштабы
потребления энергоресурсов, главным образом, определяют уровень ...
Шестая группа периодической системы
Атомы элементов VI группы характеризуются двумя
различными структурами внешнего электронного слоя содержащего либо шесть, либо
одного или двух электронов. К первому типу, помимо кислорода, относится ...
