Скорость химических реакций. Катализ и химическое равновесие
Опыт 1. Зависимость скорости реакции от температуры
В ходе опыта смешали 20 мл раствора 0,5%-ного раствора серной кислоты и 20 мл 0,5%-ного раствора серноватистокислого натрия, предварительно измерив температуру растворов. Стаканчик со смесью был поставлен на лист линованной бумаги. В результате реакции: Na2S2O3 + H2SO4 → Na2SO4 + S↓ + SO2↑ + H2O наблюдалось помутнение смеси. Был отмечен отрезок времени до условного окончания процесса.
Затем опыт был проделан ещё два раза, но температура растворов была поднята на 10˚C и 20˚C относительно первоначальной. Результаты измерений занесены в таблицу 1.
Табл. 1.
|
№ опыта |
Температура растворов, ˚C |
V(H2SO4), мл |
V(Na2S2O3), мл |
Время, с |
Условная скорость реакции |
|
1 |
20 |
20 |
20 |
90 |
1,11 |
|
2 |
30 |
20 |
20 |
20 |
5 |
|
3 |
40 |
20 |
20 |
10 |
10 |
По данным таблицы можно рассчитать температурный коэффициент Вант-Гоффа для данных реакций:
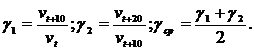
![]() ;
;
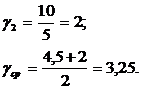
Вывод: Температурный коэффициент Вант-Гоффа для реакции разложения пероксида водорода равен 3,25.
Опыт 2. Зависимость скорости химической реакции от концентрации реагирующих веществ при постоянной температуре
В один стаканчик налили 10 мл 0,5%-ного раствора серной кислоты. В другой налили 10 мл раствора серноватистокислого натрия и 20 мл дистиллированной воды. К раствору кислоты одновременно прилили воду и раствор соли и отметили по часам продолжительность опыта. Далее опыт был повторен с изменением концентрации соли: 20 мл раствора на 10 мл воды, 30 мл раствора соли.
Результаты измерений занесены в таблицу 2.
Табл. 2.
|
№ опыта |
H2SO4, мл |
Na2S2O3, мл |
H2O, мл |
Время, с |
Усл. скорость реакции v |
|
1 |
10 |
10 |
20 |
110 |
0,909 |
|
2 |
10 |
20 |
10 |
50 |
2 |
|
3 |
10 |
30 |
- |
35 |
2,857 |
По данным измерений можно определить порядок реакции n по скоростям, соответствующим двум различным концентрациям (метод Вант-Гоффа).
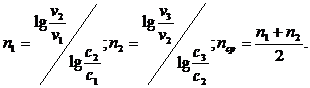
В результате вычислений получилось:
n1 = 1,1375; n2 = 0,8797; nср = 1,008 ≈ 1.
Вывод: порядок реакции n по скоростям, соответствующим двум концентрациям близок к 1.
Опыт 3. Скорость химических реакций в гетерогенных системах
В две пробирки налили соляную кислоту. Затем в одну из них положили кусочек мрамора, а в другую – такой же кусочек, растёртый в порошок. В обеих пробирках проходила реакция:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑.
Наблюдалось выделение газа. В пробирке, в которую был насыпан порошок, реакция проходила быстрее. Это объясняется тем, что площадь поверхности, на которой происходило взаимодействие веществ, была больше, чем в пробирке с цельным кусочком мрамора.
Вывод: в гетерогенных системах скорость реакции зависит от площади поверхности реагирующих веществ.
Опыт 4. Гетерогенный катализ.
а) Разложение пероксида водорода H2O2 происходит и при комнатной температуре, но довольно медленно:
H2O2 → H2O + ½O2.
Процесс разложения можно ускорить введением катализатора MnO2.
В 2 мл 3%-ного раствора H2O2 всыпали щепотку оксида марганца (IV). Скорость реакции существенно возросла, наблюдалось бурное выделение пузырьков газа.
Смотрите также
Синтез и анализ ХТС в производстве бензина
Задание
В курсовой работе осуществлён синтез и анализ
химико-технологической системы (ХТС) по производству бензина.
На основе
расходных коэффициентов и соотношения фракций готового про ...
Синтез ацетилферроцена
Ферроцен
(дициклопентадиенилжелезо) - металлорганическое соединение железа с пентагональной
антипризматической «сэндвичевой» структурой. Благодаря своему
высокосимметричному сэндвичевому ст ...
