Скорость химических реакций. Катализ и химическое равновесие
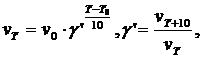
здесь γ΄ - температурный коэффициент Вант-Гоффа.
ІІ. Катализатором называется вещество, изменяющее скорость химической реакции, но в результате её само остающееся химически неизменным.
Каталитические процессы сводятся к двум типам: гомогенному и гетерогенному. При гомогенном катализе реагирующие вещества и катализатор составляют однофазную систему. При гетерогенном катализе реагирующие вещества и катализатор составляют систему из двух фаз, и каталитический процесс протекает на границах раздела. Скорость взаимодействия в этом случае пропорциональна поверхности раздела фаз.
Все химические реакции можно разделить на необратимые, направление которых не зависит от внешних условий, и обратимые, направление которых может изменяться в зависимости от температуры, концентрации и давления. Большинство реакций обратимо. Они протекают одновременно в двух направлениях, так как во всякой реакции по мере образования продуктов реакции возникает возможность взаимодействия между ними с образованием исходных веществ.
Рассмотрим обратимую реакцию в общем виде: aA+bB↔cC+dD.
Применив закон действующих масс к прямой и обратной реакциям, получим:
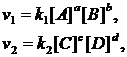 (2)
(2)
где v1 и v2 – скорости прямой и обратной реакций.
По мере протекания реакции концентрация исходных веществ уменьшается, и скорость прямой реакции уменьшается, а скорость обратной увеличивается вследствие увеличения концентрации полученных веществ.
Через некоторое время наступает состояние, когда скорость обратного процесса становится равной скорости прямого: v1=v2.
Состояние, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием, а концентрации всех четырёх веществ – равновесными концентрациями. Тогда из соотношений (2) имеем: ![]()
Отсюда следует
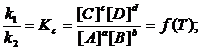 (3)
(3)
k1 и k2 для данной реакции при одной и той же температуре являются величинами постоянными, а значит, их отношение постоянно: Kc – величина постоянная и называется константой равновесия. Для реакций между газообразными веществами вместо концентраций можно использовать парциальные давления газов в смеси. При этом константу равновесия обозначают через Kp. Если концентрации выражены в мольных долях, то константа равновесия обозначается через KN. Между Kc, Kp и KN существуют следующие зависимости:
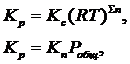
где ∑n – алгебраическая сумма стехиометрических коэффициентов. Константа равновесия зависит от температуры и природы реагирующих веществ, но не зависит от катализатора, так как последний ускоряет и прямую, и обратную реакции.
Уравнение (3) вытекает из закона действующих масс для обратимых реакций. Его можно сформулировать так: Отношение произведения равновесных концентраций в степени их стехиометрических коэффициентов есть величина, постоянная при данной температуре.
Смещение равновесия в зависимости от изменения концентраций реагирующих веществ, температуры, давления (в случае газовых реакций) в общем случае определяется правилом Ле-Шателье: если в системе, находившейся в равновесии, изменить одно из условий (t, p, c), то происходит смещение равновесия в направлении той реакции, которая препятствует произведённому изменению.
Применяя принцип Ле-Шателье к разным случаям, можно сделать следующие выводы:
1) при увеличении равновесной концентрации одного из веществ система химического равновесия смещается в сторону той реакции, которая понижает концентрацию этого вещества;
2) при увеличении давления равновесие смещается в сторону образования меньшего числа молекул газа;
3) нагревание смещает равновесие в сторону эндотермической реакции, охлаждение – в сторону экзотермической реакции.
Практическая часть
Скорость химических реакций в гомогенной системе изучается на примере взаимодействия растворов серной кислоты и серноватистокислого натрия (тиосульфата):
Na2S2O3 + H2SO4 → Na2SO4 + S↓ + SO2↑ + H2O
Сера, выделяющаяся в тонкораздробленном состоянии, даёт помутнение раствора. Момент исчезновения из поля зрения линеек или шрифта на бумаге, подложенной под стакан с реагирующим веществом, соответствует выделению определённого количества серы. Так как степень помутнения зависит от толщины слоя, то все опыты следует проводить в одном и том же стакане, чтобы объём жидкости и соответственно высота слоя были одинаковы.
Время, необходимое для выделения данного количества серы обратно пропорционально средней скорости процесса. Началом реакции считаем момент смешения растворов, условным концом реакции – выделение одного и того же количества серы.
Смотрите также
Полимеры: общий обзор класса
Полимеры - высокомолекулярные соединения, вещества с большой молекулярной
массой (от нескольких тысяч до нескольких миллионов), молекулы которых
(макромолекулы) состоят из большого числа пов ...
Перечень условных сокращений, обозначений, применяемых в
проекте.
АК - азотная кислота
СК - серная кислота
НКЛ – нитрокаллоксилин
ОК - отработанная кислота
ВКУ – вихревое контактное устройство
АСУТП – автоматизированные системы
управления технологич ...
Приложение 3
Задолженность республик
бывшего СССР
(по состоянию на 01.08.93
г.), млрд.руб.
____________________________________________________________________
Республики н ...
