Скорость химических реакций
· Скорость химической реакции. Определение.
Химические реакции протекают с разными скоростями. Из известных на сегодняшний день реакций самая быстрая протекает в 1040 раз быстрее, чем самая медленная. Превращение графита в алмаз в недрах Земли - очень медленная реакция. А взрыв смеси кислорода с водородом происходит практически мгновенно.
Как сравнить скорости реакций количественно?
Скорость - это изменение некоторой величины во времени.
Рассмотрим реакцию:
H2 + I2 = 2HI
Попробуем определить скорость этой реакции по расходованию реагентов в единицу времени. Например, так:
v(H2) = m(H2)/Dt, v(I2) = m(I2)/Dt
где v - скорость реакции, m - убыль массы соответствующего реагента, Dt - отрезок времени.
Но v(H2) не равно v(I2). Ведь массы водорода и иода, прореагировавших в единицу времени, не равны.
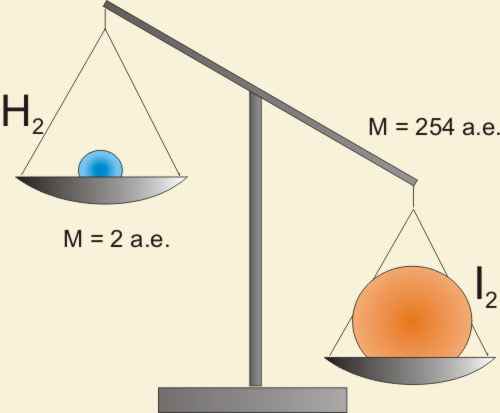
Реакция идет в мольном соотношении 1:1, а не в массовом! Попробуем по-другому:
v(H2) = n(H2)/Dt, v(I2) = n(I2)/Dt
взяв вместо масс количества веществ.
v(H2) = v(I2)
Но если в первом случае мы возьмем убыль числа молей в единицу времени в 1 мл смеси, а во втором - в 1 л смеси, то скорости снова не будут равны! Они зависят от объема. Если проводить одну и ту же реакцию в маленькой пробирке и в большой бочке, то в пробирке прореагирует меньшее количество вещества - просто потому, что там меньше реагента.
А если привести эти выражения к единице объема?
v(H2) = n(H2)/VDt = Dc(H2)/Dt, v(I2) = n(I2)/VDt=Dc(I2)/D t
где Dc изменения молярных концентраций соответствующих веществ.Тогда vH2 = vI2 = v данной реакции!
Таким образом, конечное определение будет:
|
Скорость химической реакции - это изменение молярной концентрации одного из участвующих в реакции веществ в единицу времени: v = Dc/Dt [моль/литр*сек] |
В принятом определении есть два нюанса!
Нюанс 1:
Это выражение
v = Dc/Dt
позволяет определить лишь среднюю скорость реакции за выбранный отрезок времени. Ученых же, как правило, интересует скорость в выбранный момент времени, т.е. так называемая мгновенная скорость реакции. Она определяется как производная функции c(t):
v = dc/dt
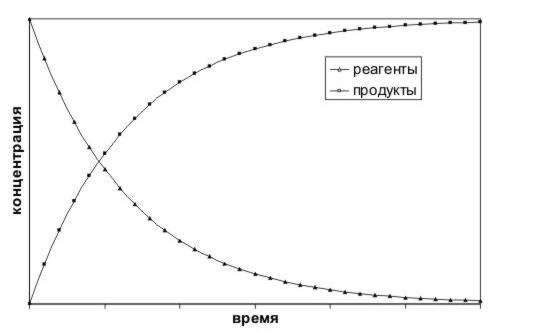
Если мы определяем скорость реакции по одному из реагентов, то знак производной c(t) отрицателен, т.к. концентрации реагентов убывают. Но по физическому смыслу скорость не может быть отрицательной величиной. Поэтому при использовании концентраций реагентов:
v = -dc/dt
Нюанс 2:
Определим скорость этой же реакции
H2 + I2 = 2HI
не по уменьшению концентрации реагента, а по увеличению концентрации продукта:
v(HI) = dc(HI)/dt
У нас получилось, что v(H2) = v(I2), но не равно v(HI)! Ведь при уменьшении концентраций водорода и иода, например, в 3 раза концентрация иодоводорода возрастает в 9 раз (это видно по коэффициентам в уравнении реакции). Чтобы скорости стали равными (и можно было говорить о единой скорости реакции), изменение концентрации HI в единицу времени следует поделить на стехиометрический коэффициент при HI:
v(HI) = dc(HI)/2dt
В общем случае для реакции
aA + bB = eE + fF
значение скорости определяется как:
v = -dc(A)/adt = -dc(B)/bdt = dc(E)/edt = dc(F)/fdt
Влияние концентраций веществ на скорость химической реакции.
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Вероятность столкновения двух людей на оживленной улице гораздо выше, чем на пустынной. Так и с молекулами. Очевидно, что вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов. Это можно продемонстрировать с помощью модели.
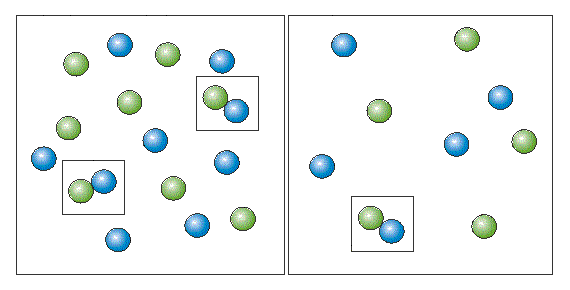
В середине XIX в. (1865 г. - Н.Н.Бекетов, 1867 г. - К.Гульдберг, П.Вааге) был сформулирован основной постулат химической кинетики, называемый также законом действующих масс:
|
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени: v = k[A]n[B]m, для реакции aA + bB = . |
Смотрите также
Основные типы химической связи
Вам известно, что атомы могут соединяться друг с
другом с образованием как простых, так и сложных веществ. При этом образуются
различного типа химические связи: ионная, ковалентная (неполярн ...
Химия платины и ее соединений
Платина – один из самых ценных благородных
металлов, обладающий рядом важных свойств, благодаря которым используется не
только в ювелирной промышленности, но и во многих отраслях ...
Апельсиновое масло
Растительные эссенции,
эфирные (ароматические) масла – это природные вещества, обладающие сильным
действием и имеющие различные полезные свойства. Они хорошо впитываются, что
немаловажно в ...
