Скорость химических реакций
Действие катализаторов основано на том, что они уменьшают энергию активации реакции.
![]() Катализ и ингибирование. Дополнительный материал.
Катализ и ингибирование. Дополнительный материал.
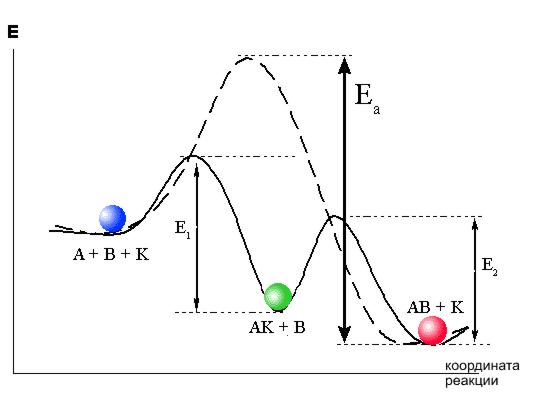
В упрощенном виде механизм действия катализатора можно представить следующим образом. Изменение энергии активации реакции происходит за счет образования катализатором К с одним из реагентов А промежуточного соединения АК:
A + K = AK (1) AK + B = AB + K (2)
Суммарная реакция
A + B = AB
BНо вместо энергетического барьера этой реакции преодолеваются более низкие барьеры реакций (1) и (2): E1 и E2.
![]()
Многие катализаторы не просто ускоряют реакции, а ведут их по другому пути. Так, реакция окисления аммиака без катализатора:
4NH3 + 3O2 = 2N2 + 6H2O
не представляет никакого интереса для промышленности, а в результате каталитического окисления на платине:
4NH3 + 5O2 = 4NO + 6H2O
получается ценный продукт - оксид азота(II).
Ингибиторы
, наоборот, увеличивают энергию активации реакции. В пищевой промышленности широко используются ингибиторы, предотвращающие гидролиз жиров, реакции окисления и брожения.
Особый случай катализа - аутокатализ, или ускорение реакции одним из ее продуктов. При этом скорость реакции не уменьшается по мере расходования реагентов, а растет. Так, реакция
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
ускоряется по мере накопления ионов Mn2+, образующихся при восстановлении перманганата.
Смотрите также
Коксохимическое производство
Основным сырьём для коксохимической промышленности
служат угли. Структура и строение углей могут быть изучены при помощи микроскопа.
Грубая структура угля, обнаруживаемая невооруженным глаз ...
Характеристика исходного сырья
Добываемая из скважин эмульсия
представляет собой многофазную систему, состоящую из нефти, пластовой воды и
попутных нефтяных газов. Нефть представляет собой химически сложную компонентную
смесь, ...
