Квантовые числа. Атомные орбитали.
ms= +1/2; –1/2.
Оно получено из опытов Штерна и Герлаха.
Рассмотренные квантовые числа определяют энергию электрона, объем и форму пространства, в котором вероятно его пребывание в околоядерном объеме, т.е. размер, форму и ориентацию орбитали в пространстве.
Так как волновая функция y является решением уравнения Шредингера при всевозможных значениях квантовых чисел, то можно сказать, что волновая функция является в свою очередь функцией рассмотренных квантовых параметров n, l и ml, где:
n= 1, 2, 3, 4,…,
l= 0, 1, 2, 3,…,n–1
ml=–l,…, –1, 0, +1,…, +l
Атомные орбитали. Так как вероятность нахождения электрона в пространстве далеком от ядра очень мала, когда говорят об орбиталях, то имеют в виду такую область вокруг ядра атома внутри которой сосредоточено 90–95% электронного заряда. С точки зрения квантовой механики атомные орбитали являются геометрическим изображением волновой функции y (n, l, ml).

 Z Электронное облако. Если бы в каждый момент времени
Z Электронное облако. Если бы в каждый момент времени
![]()
![]() y определяли положение электрона в трехмерном пространстве и
y определяли положение электрона в трехмерном пространстве и
![]()
![]()
![]() ставили в том месте точку, то через множество таких определений
ставили в том месте точку, то через множество таких определений
![]() X получили бы картину в виде пространственного облака изображен-
X получили бы картину в виде пространственного облака изображен-
![]() ного точками с размытыми краями /рис.2.3.)
ного точками с размытыми краями /рис.2.3.)
рис.2.3.
 Такое зарядовое облако называют электронным облаком. Его плотность, пропорциональная y2, является непосредственной мерой вероятности нахождения электрона. Граничная поверхность облака, внутри которой содержится 90–95% электронного заряда, дает форму орбитали.
Такое зарядовое облако называют электронным облаком. Его плотность, пропорциональная y2, является непосредственной мерой вероятности нахождения электрона. Граничная поверхность облака, внутри которой содержится 90–95% электронного заряда, дает форму орбитали.
 Z s-орбиталь. Она существует при l=0. Значение ml тоже равно
Z s-орбиталь. Она существует при l=0. Значение ml тоже равно
Y нулю. Имеем только одно значение ml =0. Следовательно,
s-орбиталь имеет максимальную симметричность. У нее
X сферическая форма (рис.2.4.). В этом случае вероятность на–
хождения электрона в околоядерном пространстве определя–
рис.2.4. ется только радиусом-вектором и не зависит от угла координат.
y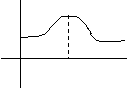 Радиальное распределение электронной плотности для 1s
Радиальное распределение электронной плотности для 1s
электрона соответствует кривой с максимумом (рис.2.5.).
Максимум распространения вероятности находится на
0 r1 r,A0 расстоянии от ядра r1, которые соответствует радиусу
рис.2.5. первой боровской орбиты.
р-орбиталь. Существует при l=1. ml = –1, 0, +1.
![]() Z р-орбиталь появляется на втором и всех последующих
Z р-орбиталь появляется на втором и всех последующих
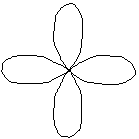 Рz уровнях. Так как ml имеет три значения, то на р-подуров-
Рz уровнях. Так как ml имеет три значения, то на р-подуров-
Y не каждого уровне может быть три р-орбитали. р-орбиталь
 имеет гонтелеобразную форму. Все три р-орбитали распо-
имеет гонтелеобразную форму. Все три р-орбитали распо-
X лагаются в пространстве по направлению координатных
Px осей. Их называют соответственно рх, рy, рz-орбитали
Py (рис.2.6.).
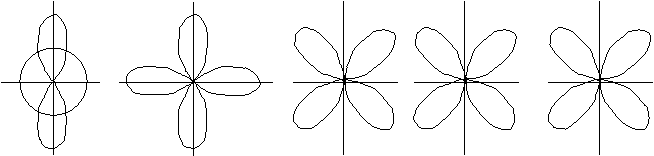 Рис.2.6. Z Y Y Z Z
Рис.2.6. Z Y Y Z Z
X X X X Y
dz2 dx2 y2 dxy dxz dyz
рис.2.7.
d-орбиталь. Появляется при l=2 на третьем квантовом уровне. На d-подуровне может быть уже пять различных состояний электронов, поэтому на d-подуровне каждого квантового уровня содержится пять d-орбиталей. В этом случае ml принимает пять значений: ml = –2, –1, 0, +1, +2, d-орбитали имеют более сложную форму, чем р-орбитали, они либо в виде четырех лепестков либо в виде гантели с ободком (рис.2.7.).
f-орбиталь. Появляется при значении l=3. f-орбитали могут быть только на четвертом и более отдаленных уровнях. Так как при l=3 ml имеет 7 значений /–3, –2, –1, 0, +1, +2, +3/, то на f-подуровне может быть семь орбиталей. Форма f-орбиталей еще более сложная, чем у d-орбиталей. f-орбитали изображают в виде сложных шестилепестковых фигур.
Смотрите также
Химические способы очистки поверхностей полупроводниковых пластин
Современный этап развития радиоэлектроники
характеризуется широким применением интегральных микросхем (ИМС) во всех
радиотехнических системах и аппаратуре. Это связано со значительным усложн ...
Свинец и его свойства
СВИНЕЦ (лат. Plumbum), Pb, химический элемент IV группы периодической
системы Менделеева, атомный номер 82, атомная масса 207,2.
...
Технология неконцентрированной азотной кислоты
Азотная
кислота по объему производства занимает среди других кислот второе место после
серной кислоты. Все возрастающий объем производства HNO3
объясняется огромным значением азотной кислот ...
