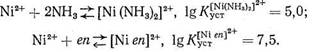Комплексы с полидентатными и макроциклическими лигандами
Основной особенностью биолигандов является их принадлежность к числу полидентатных и (очень часто) макроциклических лигандов.
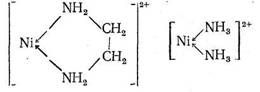
Как известно, особая устойчивость комплексных соединений, образованных ионами металла с полидентатными лигандами, объясняется образованием одной молекулой (или ионом) лиганда с данным центральным ионом (катионом металла) одного или нескольких хелатных циклов. Согласно правилу Чугаева, наиболее устойчивыми являются пятичленные хелатные циклы (для систем без кратных связей) и шестичленные циклы (для систем с сопряженными двойными связями). Напомним, что энергетическая выгодность замыкания хелатных циклов (хелатный эффект) определяется как энтропийным, так и эн-тальпийным факторами. Рассмотрим в качестве примера комплексообразование Ni2+ с аммиаком и этилендиамином еп:
|
|
В обоих комплексах ион Ni2+ координирует два атома азота. Большая величина Kуст в случае этилендиаминового комплекса, несомненно, связана с хелатным эффектом: в комплексе [Niеn]2+ имеется пятичленный хелатный цикл, тогда как у комплекса [Ni (NH3)2]2+ — «открытое» строение:
|
|
Координационно насыщенные аммиакаты Ni2+ имеют состав [Ni(NH3)4]2+ или [Ni(NH3)6]2+.
Установлено, что разница в величинах констант устойчивости этих двух комплексов (A lgKуст = 2,5) определяется энтальпийным (∆H= -1,9 ккал/моль) и энтропийным вкладом (∆S = 6,2 кал/град*моль). Разницу в величинах энтальпии образования этих соединений объясняют тем, что в случае [Nien]2+ двум атомам азота, входящим в координационную сферу Ni2+, не нужно преодолевать взаимного отталкиваия (в отличие от комплекса [Ni (NH3)2]2+). Атомы азота этилендиамина уже включены в состав одной молекулы («сближены» друг с другом). Кроме того, при образовании [Niеn]2+ меньше энергии требуется для дегидратации лиганда, чем в случае [Ni (NH3)2]2+: молекулы аммиака меньше по размеру, чем еп, они сильнее гидратируются.
Разница в величинах энтропийных факторов при образовании хелатного и «открытого» комплексов обусловлена увеличением числа частиц при протекании реакции тогда как при синтезе в водном
![]()
растворе диаммиаката никеля (II) в результате комплексообразования число частиц не меняется:
|
|
что связано с бидентатностью еп и монодентатностью NH3.
Как указывает Яцимирский, кроме хелатного эффекта в природных металлокомплексах, образованных биолигандами, часто осуществляется макроциклический эффект. В качестве примера рассматриваются термодинамические характеристики комплексов меди с лигандами L` и L" одинаковой дентатности и сходной природы, но только в L" цепь замкнута в макроцикл:
Смотрите также
Атмосфера
...
Особенности кинетики реакций на поверхности гетерогенных катализаторов
Рассмотрим подробнее применение закона действия масс
для реакций на поверхности. Для описания скорости элементарной стадии
используют закон действия поверхностей. Если процесс определяется с ...
Приложение 4
Добыча нефти без газового
конденсата за 1993 год в тоннах
(по способам добычи)
Российская Федерация
Насосный 283708241
т.
Электропогружными насос ...