Бионеметаллы и биометаллы
В биологических процессах участвует большое число химических соединений, образованных различными элементами периодической системы. Организмы животных и растений состоят из сложных веществ, включающих в свой состав как элементы-неметаллы, так и элементы с металлическими свойствами. Из неметаллов особенно важную роль играют углерод, водород, кислород, азот, фосфор, сера, галогены. Из металлов в состав животных и растительных организмов входят натрий, калий, кальций, магний, железо, цинк, кобальт, медь, марганец, молибден и некоторые другие.
Для того чтобы оценить соотношение количеств химических элементов, входящих в состав живых организмов, полезно рассмотреть содержание биоэлементов в организме «среднего» здорового человека (вес 70 кг). Установлено, что на 70 кг массы человека приходится 45,5 кг кислорода (т. е. больше половины массы), углерода—12,6, водорода — 7,0, азота — 2,1 кг, примерно столько же фосфора. Кальция в человеке 1,7 кг, калия — 0,25, натрия — 0,07 кг, магния — 42 г, железа — только 5 г (химики шутят, что железа в человеке хватит лишь на один гвоздь), цинка — 3 г. Остальных металлов в сумме меньше, чем 1 г. В частности, меди — 0,2 г, марганца — 0,02 г.
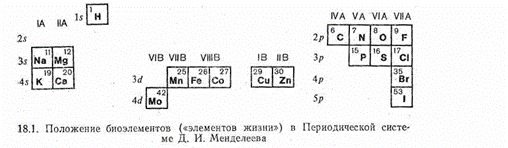
Интересно, что вхождение химических элементов в состав живых организмов не зависит каким-либо простым образом от их распространенности. Действительно, хотя наиболее распространенный на земле элемент — кислород — является важнейшей составной частью соединений, слагающих растительные и животные организмы, такие распространенные элементы, как кремний и алюминий, в их состав не входят, а относительно мало распространенные кобальт, медь и молибден выполняют важную биологическую роль. Следует отметить также, что среди биоэлементов, т. е. элементов, играющих важную роль в построении живого организма и в процессах поддержания его жизни (обмен веществ, метаболизм), находятся очень сильно различающиеся по своим химическим свойствам, размерам частиц и электронному строению металлы и неметаллы. Например, среди биометаллов (их часто называют «металлами жизни») есть элементы, образующие ионы с благородногазовой электронной «подкладкой», несклонные к проявлению переменной валентности (Na+, K+, Mg2+, Са2+). Наряду с этим есть среди биометаллов и элементы с 18-электронной (Zn2+) или недостроенной 18-электронной «подкладкой» (Cu2+, Co2+, Fe2+, Fe3+, Mo(V), Mo(VI)). Последние склонны изменять степень окисления в ходе обмена веществ.
Среди перечисленных биометаллов есть элементы, образующие преимущественно ионные (Na, К) и ковалентные связи (Mo, Zn); сильные комплексообразователи, такие, как Fe3+, Co2+, Cu2+, Zn2+. Однако и менее прочные комплексы, образованные, например, ионами Са2+, Mg2+, Mn2+, играют важную биологическую роль, и даже ионы щелочных металлов (Na+, К+) в метаболических процессах вовлекаются в образование комплексов (с участием макроциклических лигандов). Установлено, что большое значение имеют размеры ионов металлов, участвующих в процессах метаболизма.
Так, например, не очень большая разница в величинах ионных радиусов Na+ (0,98 А) и К+ (1,33 А) обусловливает очень большую разницу в радиусах гидратированных ионов. Это приводит к неодинаковой роли ионов Na+ и К+ в процессе метаболизма: Na+ — внеклеточный, а К+—внутриклеточный ионы. Именно размеры ионов, а также характерный для данного иона тип химической связи определяют, на какие ионы может замещаться тот или иной ион в процессе метаболизма. Установлено, что ионы К+ могут замещаться в живых тканях на крупные однозарядные катионы щелочных металлов (Rb+, Cs+), а также на сходные по размерам ионы NH4+ и Т1+. Напротив, относительно маленький ион Na+ может замещаться только на Li+. Интересно, что обмен на ионы Cu+ не происходит, видимо, из-за склонности Cu+ к образованию ковалентных связей, хотя размеры Cu+ и Na+ сходны.
Очень важно, что ионы Mg2+ и Са2+ в биосистемах не замещают друг друга. Это связано, как полагают, с большей ковалентностью связи Mg2+ с лигандами по сравнению с Са2+. Еще более ковалентные связи с лигандами образует Zn2+, он не замещается на Mg2+, хотя близок к нему по величине ионного радиуса.
Согласно. К. Б. Яцимирскому, оценку ионности и ковалентности связей ионов биометаллов с лигандами целесообразно проводить следующим образом. Ионность связи пропорциональна отношению квадрата заряда иона к величине ионного радиуса. Это отношение для большинства ионов находится в пределах от 1 до 5. Только для бериллия это отношение аномально велико и составляет 11,7. Именно с этим связывают высокую токсичность иона Ве2+.
Ковалентность связи металл—лиганд, по Яцимирскому, можно оценить как отношение
Смотрите также
Список
сокращений
1.
БЕ
– буферная емкость.
2.
БР
– блок подготовки и закачки реагента.
3.
БРХ
– блок реагентного хозяйства.
...
Химия в сельском хозяйстве и её направления
Химизация — это одно из направлений научно-технического прогресса,
основанное на широком применении химических веществ, процессов и методов в
различных отраслях, например в сельском хозяй ...
Галлий и его соединения
ГАЛЛИЙ, (лат. Gallium) Ga
...
