4. Изопроцессы в термодинамике. Энергия Гельмгольца
1. Изотермический
– Т= const 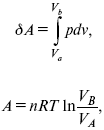
так как 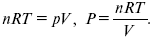
2. Изохорный
– V = const
δА = 0,
δА = pdυ = 0,
δQ = dU + pdυ,
δQ = CvdT.
3. Изобарный
– P = const
δА = pdυ,
A = pV2 – pV1.
4. Адиабатический
– δQ = 0
1) δA = –dU,
A = –CV(T2 – T1), T2 > T1;
2) pd δ= –CvdT, 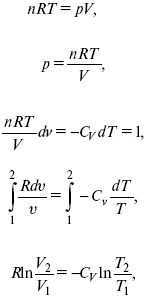
действие, обратное логарифму – потенцирование
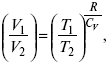
Уравнение первого закона термодинамики в калорических коэффициентах
δQ = ldυ + CVdT,
где l – коэффициент изотермического расширения;
CV – теплоемкость при постоянном объеме. 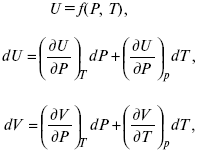
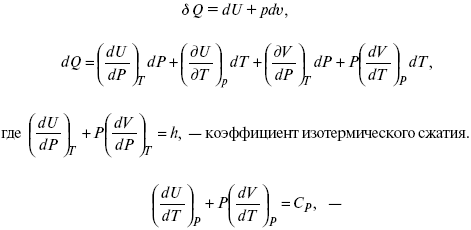
теплоемкость при const давлении,
δQ = hdP + CpdT ,
δQ = χdP + ψdυ.
Связь между функциями CP и CV
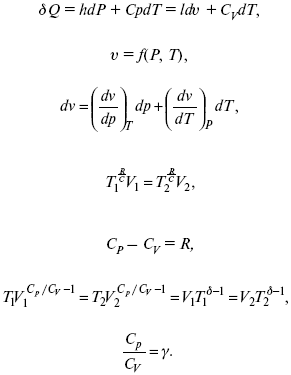
Смотрите также
Химия и медицина
...
Синтез и анализ ХТС в производстве азотной кислоты
...
Полимеры
Литературный обзор
Получение
слоистых пластиков связано с изготовлением на разных этапах технологического
процесса слоистых наполнителей – тканей, бумаг, шпона - поверхность которых
по ...
