Атомно-кристаллическое строение металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Атомы в кристалле расположены в определенном порядке, который периодически повторяется в трех измерениях.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узле которой располагаются атомы (ионы), образующие металл.
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки (решетки).
Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки a, b, c и три угла между ними α, β, γ. Эти величины называют параметрами кристаллической решетки.
Кристаллические решетки бывают простыми (атомы только в вершинах решетки) и сложными.
Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: кубическую объемноцентрированную (ОЦК), кубическую гранецентрированную (ГЦК) и гексагональную (ГПУ) (рис. 2).
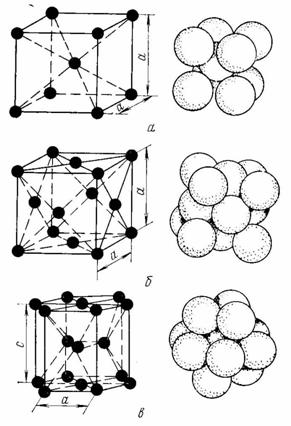
ОЦК: Rb, K, Na, Li, Tiβ, Tlβ, Zrβ, Ta, W, V, Feα, Cr, Nb, Ba, и др.
ГЦК: Cu, Al, Pt, Pb, Ni, Ag, Au, Pd, Rh, Ir, Feγ, Coα, Caα, Ce, Srα, Th, Sc и др.
ГПУ: Mg, Cd, Re, Os, Ru, Zn, Be, Coβ, Caα, Zrα, Laα, Tiα и др.
Рисунок 2. Кристаллические решетки металлов и схемы упаковки атомов
Расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку, называют периодом решетки, измеряется в нанометрах (1нм = 10-9см = Å= 10-8см).
Периоды решетки металлов находятся в пределах 0,2 – 0,7 нм.
Для ОЦК: a, b, c; a = b = c.
Для ГЦК: a, b, c; a = b = c.
Для ГПУ: а, с; с/а = 1,633 (к Zn не относится)
Число атомов в каждой элементарной ячейке (плотность упаковки – равняется числу атомов, приходящихся на одну элементарную ячейку):
ОЦК: ПУ (плотноупакованная) = ![]() ;
;
ГЦК: ПУ = ![]() ;
;
ГПУ: ПУ = ![]() .
.
Координационное число – под ним понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов:
ОЦК: расстояние (min) между атомами ![]() , на этом расстоянии от рассматриваемого атома находится 8 соседей – К8 .
, на этом расстоянии от рассматриваемого атома находится 8 соседей – К8 .
ГЦК: ![]() , К12.
, К12.
ГПУ: Г12 (с/а = 1,633).
Коэффициент заполнения ячейки (плотность укладки) – определяется как отношение объема, занятого атомами к объему ячейки:
ОЦК: 68%
ГЦК: 74%
ГПУ: 74%
Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Атомный радиус возрастает при уменьшении координационного числа.
Смотрите также
Результаты ТД расчета и экспериментального исследования
системы Аl - АГСВ - каталитические
добавки
В данной главе
представлены данные термодинамического расчета характеристик базовых систем и
экспериментальные характеристики зажигания и горения исследуемых систем. ...
Синтез и анализ ХТС в производстве ацетона
Задание
Какое количество гидроперекиси
изопропилбензола необходимо, если известно, что в процессе разложения
получается 6 т. толуола, степень разложения 80 %
...
