Обратимость химических реакций. Химическое равновесие и условия, которые влияют на смещение химического равновесия.
Химическая реакция – процесс, при котором из одних веществ получаются другие. Как известно, по признаку процесса различают несколько типов реакций: разложения, замещения и т. д. По характеру обратимости реакции делятся на обратимые и необратимые. Реакции, протекающие в одном направлении и приводящие к полному превращению исходных веществ в продукты реакции, называются необратимыми:
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
Обратимыми называются реакции, которые одновременно идут в двух взаимно противоположных направлениях: слева направо – прямая, справа налево – обратная. Обе реакции идут с определенной скоростью. В ходе обратимой реакции концентрация исходных веществ уменьшается, а концентрация продуктов реакции увеличивается. Соответственно скорость прямой реакции будет уменьшаться, а обратной – увеличиваться до тех пор, пока эти скорости не станут равными. Состояние системы, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием. При состоянии химического равновесия реакция не прекращается, а обе реакции идут с равными скоростями
Выразим скорости прямой и обратной реакций:
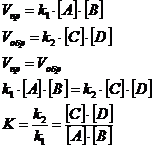
К – константа химического равновесия.
Полученное уравнение выражает закон “Действующих масс” для химического равновесия. При установившемся химическом равновесии отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ есть величина постоянная при определенных условиях. Физический смысл константы химического равновесия состоит в том, что она показывает во сколько раз прямая реакция идет быстрее обратной. Если K>1, то преобладает прямая реакция, если K<1 – обратная. Это положение дает возможность не только определить направление реакции, но и регулировать любой химический процесс, смещая его в ту или иную сторону.
При изменении температуры, давления или концентрации регентов равновесие может сместиться. Изменения, происходящие в системе в результате внешних воздействий, определяются принципом «подвижного равновесия» или принципом Ле-Шателье:
Внешние воздействия на систему, находящуюся в состоянии химического равновесия, приводят к смещению этого равновесия в направлении, при котором ослабевает эффект произведенного воздействия.
[c]:
при увеличении концентрации одного из реагирующих веществ равновесие сместится в сторону расхода вводимого вещества, при уменьшении концентрации равновесие сместится в сторону образования этого вещества.
[t]:
при повышении температуры равновесие сместится в стороны эндотермической реакции, при понижении – в сторону экзотермической реакции.
[p]:
при увеличении давления равновесие сместится в сторону уменьшения газообразных веществ, при уменьшении – в сторону увеличения газообразных веществ. Если реакция протекает без изменения числа молекул газообразного вещества, то давление не влияет на химическое равновесие.
Смотрите также
Атомно-молекулярное учение
Период с 1200 по 1700 г. в истории химии принято называть алхимическим. Движущей силой
алхимии в течение 5 веков
являлся бесплодный поиск некоего философского камня, превращающего
благород ...
