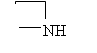
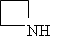
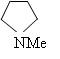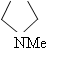Закономерности, выявленные для основности
Наличие свободной электронной пары у атома N придаёт аминогрупам основные свойства. В соответствии с теорией Брауна. Основание является акцептором протона: образуется протонированная форма амина. Согласно определению Льюиса, атом может образовывать связь с кислотами Льюиса, т. е. С любыми частицами, имеющими орбиталь, способную принять участие в создании связи с использованием электронной пары основания.
![]() R3N: + AH R3N+H + A- (1)
R3N: + AH R3N+H + A- (1)
Равновесие кислота — основание устанавливается довольно быстро, и при обсуждении основности следует рассмотреть положение равновесия в данной системе. Оно определяется разностью свободных энергий DG0 основания и сопряженной кислоты. На относительную устойчивость этих двух частиц влияют три основных фактора: электронные факторы, природа растворителя и структурные особенности, которые будут рассмотрены ниже.
Влияние электронных факторов на основность можно оценить с помощью данных об основности в газовой фазе, полученных рядом методов, таких, например, как масс-спектрометрия или ионный циклотронный резонанс. Эти методы позволяют изучать ион-молекулярные взаимодействия и рассчитывать DG0 по уравнению 3, где GB — основность в газовой фазе,
![]() АН+В ВН + А (2) DG0 = GB(А)-GB(В) (3)
АН+В ВН + А (2) DG0 = GB(А)-GB(В) (3)
Результаты, полученные при изучении большого числа алкиламинов, были использованы для количественной оценки влияния алкильных групп на основность самих аминов. Порядок возрастания этого влияния согласуется с увеличением электронодонорного «индуктивного эффекта» алкильных групп, который оказывает сравнительно более сильное стабилизующее воздействие на протонированные формы аминов, чем на свободные амины. В соответствии с этим наблюдается увеличение основности, например, в следующем ряду:
NН3 < МеNН2 < ЕtNН2 < н-BuNН2 < Ме2NН < Ме3N < Еt3N < н-Вu3N
Понятие “индуктивный эффект” достаточно хорошо обосновано экспериментально и является очень полезным для химиков-органиков, однако стало очевидным, что алкильные группы способны стабилизовать не только положительные, но и отрицательные ионы. Это следует из характера кислотности спиртов в газовой фазе (ВuОН > EtOН > МеОН > Н2О) и влияния алкильных заместителей на увеличение силы кислоты в растворе. Этот эффект можно представить как результат делокализации .положительного или отрицательного заряда в молекуле вследствие поляризации различных связей. Как и следует ожидать, .электроотрицательные атомы понижают основность, например, в ряду:
СН3СН2NН2 > FСН2СН2NH2 > F2СНСН2NН2 > F3ССН2NH2
Оценка основности в газовой фазе относительно аммиака
![]() NH4 + B NH3 + BH
NH4 + B NH3 + BH
DG0 = GB(NH3) - GB(В)
Таблица 2. Основность некоторых аминов в газовой фазе
|
соединение |
DG0, кДж/моль |
соединение |
DG0, кДж/моль |
|
|
-101,7 |
|
-75,0 |
|
|
-103,0 |
|
-46,9 |
|
|
-84,2 |
|
-64,9 |
|
|
-84,6 |
|
-28,1 |
|
|
-75,4 |
|
-47,3 |
|
|
-54,4 |
Смотрите также
Приложение 5
Добыча нефти включая газовый
конденсат, за 1993 г. в тоннах (по компаниям)
Российская Федерация 339653933
Западная Сибирь 237353903
Тюмень ...
Технико-экономические расчеты к проекту отделения переработки КХК (коллективного химического концентрата) в концентрат РЗЭ
Задание по
курсовому проекту
Провести
технико-экономические расчеты к проекту отделения переработки КХК
(коллективного химического концентрата) в концентрат РЗЭ, производительностью
150 ...