Пример 2
Каталитический активированный комплекс типа Аррениуса.
Разложение муравьиной кислоты в среде концентрированной серной кислоты
![]()
![]()
![]()
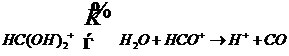
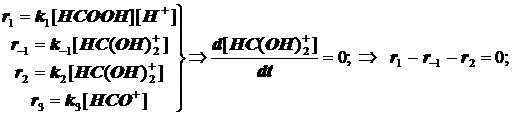
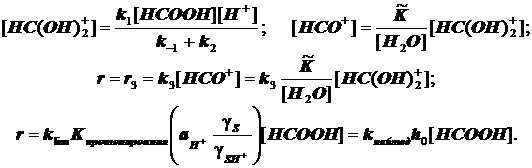 (11.9)
(11.9)
Полезно привести некоторые общие инженерно-технологические соображения.
Продукты гомогенно-катализируемой реакции находятся в одной фазе с реагентами, исключая те редкие случаи, когда они удаляются в отдельную фазу (из жидкости в виде газа, либо из газа или жидкости в виде осадка, либо иногда выделяются в виде несмешивающейся жидкости). По этой причине в реальных условиях почти всегда возникает потребность в разделении реакционной смеси. Технологическое оформление процессов разделения обычно стоит дорого, нередко намного дороже самого синтеза. Согласно простейшей термодинамической оценке энергетические затраты на разделение смеси не могут быть менее полезной работы образования смеси из компонентов, по абсолютной величине равной
![]() .
.
Реальные энергозатраты всегда существенно больше этого нижнего предела, и поэтому желанными являются такие технологические процессы, в которых необходимость в процессах разделения минимальна, и это уже ближе к предмету гетерогенного катализа .
Гомогенно-каталитизируемое превращение протекает в одной фазе, где смешаны и реагенты, и катализатор, и продукты. В гетерогенно-катализируемом превращении катализатор образует отдельную фазу, а химический элементарный акт протекает на её поверхности и пространственно как бы отделён от основной массы и реагентов, и продуктов. Поэтому для кинетического моделирования этого сложного превращения его необходимо представить как результат суперпозиции нескольких элементарных процессов. Это:
- 1) Диффузия реагента из объёма к поверхности катализатора (массоперенос).
- 2) Адсорбция реагента на поверхности катализатора.
- 3) Химическое превращение реагента в продукт на поверхности катализатора.
- 4) Десорбция продукта с поверхности катализатора.
- 5) Диффузия продукта от поверхности катализатора в объём (массоперенос).
Эти элементарные процессы удобно математически вначале смоделировать по отдельности:
1) Диффузия из объёма к поверхности
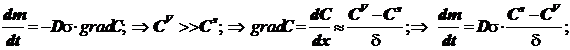 (12.1)
(12.1)
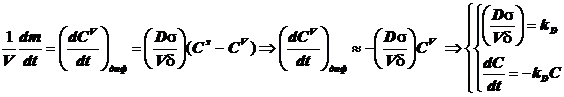 ; (12.2)
; (12.2)
Уравнение массопереноса под влиянием диффузии имеет первый порядок по концентрации. Формально оно не отличается от обычного кинетического уравнения. Диффузия - процесс активационный с относительно небольшой энергией активации - всего около 4-9 кДж/моль.
2) Режим диффузионнный и режим кинетический.
В стационарном режиме скорость химического превращения на поверхности
равна скорости диффузии вещества из объёма к поверхности:
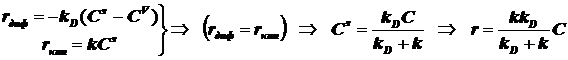 ; (12.3)
; (12.3)
Отсюда появляется две возможности -два возможных режима процесса:
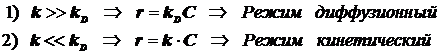 (12.4)
(12.4)
3)Адсорбция на поверхности. Уравнение Лангмюра для одного адсорбата.
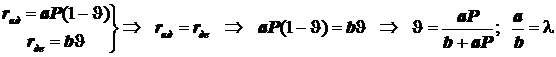
![]() ;
; 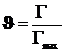 ;
; ![]() ; (12.5)
; (12.5)
Кривая Лангмюра в области начала кривой
![]() адсорбции может быть заменено более простым
адсорбции может быть заменено более простым
уравнением Бедекера-Фрейндлиха: ![]()
Рис.24. Кривая адсорбции.
Смотрите также
Что такое природный газ?
Еще три
века назад слова “газ” не существовало. Его впервые ввел в XVII веке голландский ученый Ван-Гельмонт. Оно определяло вещество, в
отличии от твердых и жидких тел способное ...
