Хром
Физические свойства:
Хром — твердый голубовато-белый тугоплавкий металл. Температура плавления 1890°С.
На воздухе покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления. Благодаря этому свойству хром является одним из самых коррозион-ностойких металлов.
Химические свойства:
При комнатной температуре хром не взаимодействует ни с водой, ни с кислородом воздуха.
Растворяется в соляной и разбавленной серной кислотах с выделением водорода:
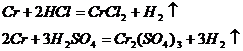
Азотная кислота пассивирует хром.
Применение:
Используется для хромирования в гальванотехнике при нанесении декоративных и износостойких гальванических покрытий, а также в качестве добавок к легированным сталям. Хром входит в состав нержавеющих, кислотоупорных, жаропрочных сталей, которые отличаются повышенной твердостью и прочностью.
ХРОМА КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
1. Соединения хрома (II).
Оксид хрома (II) CrO — имеет основной характер, взаимодействует с кислотой:
![]()
Хлорид хрома (II) — раствор голубого цвета. При взаимодействии с щелочью выпадает желтый осадок гидроксида хрома Сг(ОН)2:
![]()
Соединения хрома (II) неустойчивы и окисляются на воздухе в соединения хрома (III).
2. Соединения хрома (III).
Оксид хрома (III) ![]() — тугоплавкое вещество зеленого цвета, является амфотерным оксидом, в воде нерастворим.
— тугоплавкое вещество зеленого цвета, является амфотерным оксидом, в воде нерастворим.
Оксид хрома (III) растворим в кислотах и щелочах. При сплавлении с щелочами образуются растворимые в воде соли хромистой кислоты — хромиты:
![]()
При сплавлении оксида хрома (III) с щелочью в присутствии кислорода воздуха получают хроматы — соли хромовой кислоты желтого цвета:
![]()
При взаимодействии с кислотами образуются соли хрома (III):
![]()
Гидроксид хрома (III) Сг(ОН)з выпадает в виде синевато-серого осадка при действии на соли хрома (III) щелочью:
![]()
Гидроксид хрома (III) обладает амфотерньши свойствами:
— взаимодействует с щелочами и с кислотами
![]()
3. Соединения хрома (VI).
Оксид хрома (VI) ![]() (хромовый ангидрид) — обладает кислотными свойствами: взаимодействует с щелочами с образованием хроматов (солей хромовой кислоты):
(хромовый ангидрид) — обладает кислотными свойствами: взаимодействует с щелочами с образованием хроматов (солей хромовой кислоты):
![]()
Хромовый ангидрид ![]() образует две кислоты:
образует две кислоты:
—хромовую ![]()
![]()
—
дихромовую ![]()
![]()
Обе эти кислоты существуют только в водном растворе. Состояние равновесия:
![]()
жёлтый оранжевый
зависит от кислотности среды: в кислом растворе основная масса хрома находится в виде дихромата (![]() ), а в щелочном — в виде хромата (
), а в щелочном — в виде хромата (![]() ).
).
Смотрите также
Технология неконцентрированной азотной кислоты
Азотная
кислота по объему производства занимает среди других кислот второе место после
серной кислоты. Все возрастающий объем производства HNO3
объясняется огромным значением азотной кислот ...
Целлюлоза
...
Приложение 2
Добыча нефти, включая
газовый конденсат в СССР по годам
Годы 1920 1940 1950 1960 1970 1975 1980 1985
_______________________________________________________
Кол-во ...
