Углерод
-С 154 пм. Интересно, что меньшему содержанию фтора отвечает большее расстояние между слоями (до 880 пм для СF0,68). Фторид представляет собой серебристо-белое, в тонких слоях прозрачное вещество, не проводящее электрический ток и чрезвычайно химически стойкое (не взаимодействует ни с кислотами, ни со щелочами). Однако длительным действием водорода в момент выделения (цинковая пыль
+ уксусная кислота) фтор может быть извлечён с восстановлением графитной структуры. Нагревание CF выше 500
°С сопровождается энергичным (вплоть до взрыва) разрушением этого вещества с образованием летучих фторидов углерода (CF4, C2F6 и др.) и выделением сажи.
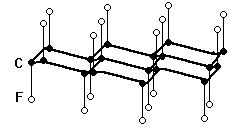
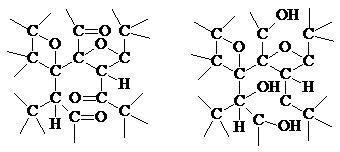
Рис. 3. Схема структуры слоя CF. Рис. 4. Схемы структуры слоёв в продуктах окисления графита.
Действие на графит смеси фтора с избытком фтористого водорода при обычных условиях ведёт к увеличению расстояния между слоями до 540 пм и образованию чёрного вещества предельного состава С4F, также содержащего ковалентные связи С
-F с расстоянием F
-F 490 пм. Сами углеродистые “паркеты” при этом не изменяются, но становятся расположенными точно друг над другом (структура АААА .). Этот фторид проводит электрический ток, однако, примерно в 1000 раз хуже графита. Химически он очень устойчив, но при нагревании уже выше 100
°С начинает разлагаться.
Кислородсодержащие графитиды (“оксиды графита”, “графитовые кислоты”) образуются при длительном действии на графит сильных окислителей (например КС1О3 со смесью конц. серной и азотной кислот). После отмывки водой получают вещества коричневого, жёлтого или белого цвета. При сушке окисленного продукта над Р2О5 расстояние между слоями углеродных атомов 640 пм, при сушке на воздухе 900 пм, а в воде оно увеличивается до 1100 пм. Сами слои углеродных атомов графита претерпевают сильное искажение, предположительно за счёт возникновения связей С
-О
-С, С=О и С
-О
-Н.
Кислородные производные графита проявляют слабовыраженный кислотный характер. Они обладают также окислительными свойствами и под действием некоторых восстановителей (например НI и даже НBr) легко превращаются в графитоподобные продукты восстановления. В связи с наличием окислительных свойств предположили, что кислород в окисленном графите содержится в виде пероксидных групп (
-О
-О
-), связывающих отдельные слои атомов углерода друг с другом. Это не противоречит и кислотным свойствам окисленного графита, происхождение которых может быть обусловлено гидролизом по схеме
:
С
-О
-О
-С + Н2О = СООН + СОН.
Вопрос о структуре окисленных форм графита нельзя считать окончательно разрешённым. При медленном нагревании этих форм происходит их возврат к структуре графита (с отщеплением СО2), а при быстром — распад с образованием СО, СО2 и сажи.
Для представителей второй группы продуктов внедрения в графит характерно наличие смещённых влево равновесий по схемам:
Сп + Х
Û Сп
- + Х+ .
Простейшими примерами таких систем могут служить производные калия и брома, предельные составы которых отвечают формулам С8К и С8Br.
Смотрите также
Расчет сметной стоимости проектируемого объекта
Капитальные
вложения в проектируемый объект принято называть полной сметной стоимостью
этого объекта. В проектных организациях расчет капитальных затрат
осуществляется путем составления локальных с ...
Кислород
КИСЛОРОД (лат. Oxygenium), O (читается «о»),
химический элемент с атомным номером 8, атомная масса 15,9994. В периодической
системе элементов Менделеева кислород расположен во втором периоде ...
Качественный анализ анионов
Цель аналитической химии - установление качественного и количественного
состава вещества или смеси веществ. В соответствии с этим аналитическая химия делится
на качественный и количественны ...
