Углерод
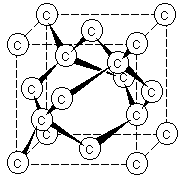
Рис. 1. Схема расположения атомов С в алмазе. Рис. 2. Обычная огранка бриллианта.
Структуру алмаза можно представить в виде тетраэдров с атомом углерода в центре, которые повторяются в бесконечности в трех измерениях (рис. 1). Алмаз имеет атомную кристаллическую решетку.
Несмотря на свою твердость, алмаз хрупок и легко раскалывается от удара. Он хорошо проводит тепло, но практически не проводит электрический ток. Не все алмазы бесцветны, некоторые из них имедт окраску, от лишь слегка наметившейся до интенсивной. По отношению к рентгеновским лучам алмаз прозрачен (в отличие от подделок), а для ультрафиолетовых одни кристаллы прозрачны, другие нет.
Алмаз отличается большой инертностью: на него не действуют ни кислоты, ни щелочи. На воздухе алмаз горит при температере около 900
°С, а в кислороде — около 700 °С. После сгорания остаётся немного золы (0,02 вес. % и более), что свидетельствует о наличии в природных алмазах примесей (главным образом алюминия, кремния, кальция и магния). При нагревании выше 1200
°С в отсутствие воздуха начинается графитизация алмаза.
В кристаллах алмазов обычного типа небольшая (порядка 1:1000) часть атомов углерода заменена на атомы азота. Из представителей более редкого типа особенно интересны светло-голубые алмазы, электропроводность которых сравнительно выше, чем у прочих образцов. При нагревании выше 100 °С они приобретают полупроводниковые свойства р-типа, сохраняющиеся в атмосфере водорода до 1100
°С.
Наиболее красивые алмазы шлифуют и под названием бриллиантов (рис. 2) употребляют в качестве украшений. Для их расценки служит применяемая к драгоценным камням единица массы — карат (0,2 г). Самый крупный добытый алмаз (“Куллинан”) весил 3026 каратов, т.е. более 600 г.
Исключительная твердость алмаза обусловливает его ценность для техники. Промышленность использует все те камни (громадное большинство), в которых имеется какой-либо изъян (некрасивая окраска, трещины и т. д.), делающий их непригодными в качестве украшений.
Сравнительно невысокая цена таких камней с браком позволяет употреблять их непосредственно или в форме алмазного порошка для заточки и шлифовки режущих инструментов из твердых сплавов, правки шлифовальных кругов, при буровых работах в горном деле (алмазное бурение), резке стекла и твердых каменных пород, сверлении стали, обточке металлических валов. Использование алмазов резко повышает скорость и качество обработки самых разнообразных материалов.
“Если бы США были отрезаны от их современных источников алмазов, то их промышленный потенциал за очень короткий срок упал бы наполовину.” (Левис). Ежегодная мировая добыча алмазов около 5 т.
Существует предположение, что исходным материалом для природного синтеза алмазов служил углерод, возникавший в результате восстановления (при высоких температурах и под большим давлением) карбонатных пород двухвалентным железом по примерной суммарной схеме:
СаСО
3
+ 5 FeO = Ca(FeO2)2 + Fe3O4 + C.
Необходимое для кристаллизации углерода в форме алмаза очень высокое давление создавалось за счет его случайных местных повышений.
Смотрите также
Электрохимические процессы на границе. Твердый электролит. Соединения внедрения
...
Бром
...
