Сера
Чистая сера представляет собой жёлтое кристаллическое вещество с плотностью 2,1 г/см3, плавящееся при 119 °С и кипящее при 445 °С. Она очень плохо проводит тепло и электричество. В воде сера нерастворима. Лучшим её растворителем является сероуглерод (СS2).
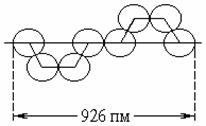
Элементарная сера существует при обычных условиях в виде восьмиатомных кольцевых молекул (рис. 2). Кристаллы образованные молекулами S8 имеют две формы. Ниже 95,4 °С устойчива обычная жёлтая сера с плотностью 2,07 г/см3, кристаллизующаяся в ромбической системе и имеющая т. пл. 112,8 °С (при быстром нагревании). Напротив, выше 95,4 °С устойчивы бледно-жёлтые кристаллы моноклинной серы с плотностью 1,96 г/см3 и т. пл. 119,3 °С (Sb) (рис. 3). Теплота превращения одной формы в другую составляет 3 кДж/моль. Интересно, что при трении сера приобретает сильный отрицательный заряд, а при охлаждении ниже -50 °С обесцвечивается.
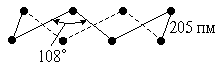
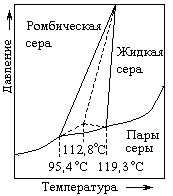
Рис. 2. Строение молекулы S8. Рис. 3. Диаграмма состояния серы.
В особых условиях удавалось получать для серы малоустойчивые разновидности и иных типов. Например, при замораживании (жидким азотом) сильно нагретых паров серы получается ее устойчивая лишь ниже -80 °С пурпурная модификация, образованная молекулами S2. Лучше других изучена форма, извлекаемая толуолом из подкисленного раствора Nа2S2O3. Ее оранжево-жёлтые кристаллы образованы кольцеобразными молекулами S6 [с параметрами d(SS) = 206 пм и ÐSSS = 102°]. Резким охлаждением насыщенного раствора серы в бензоле может быть получена состоящая из молекул S8 метастабильная ”перламутровая” модификация (Sg). Довольно сложным путем была получена форма, слагающаяся из циклических молекул S12 [d(SS) = 206 пм, ÐSSS = 106,5°]. Известны также формы, образованные молекулами S7 и S10.
Имеющиеся пока сведения о поведении серы при высоких давлениях неполны и отчасти противоречивы. Так, по одним данным, в области около 30 тыс. атм. и 300 °С формы кристаллов серы. устойчива кубическая фаза с плотностью 2,18 г/см3, по другим — в той же области устойчива обладающая ромбической решеткой “волокнистая” сера, слагающаяся из десятиатомных спиралей (с тремя оборотами на период 138 пм). Предполагается, что при 200 тыс. атм. сера может быть переведена в металлическое состояние.
Теплота плавления серы составляет 1,3 кДж/моль. Плавление сопровождается заметным увеличением объема (примерно на 15 %). Расплавленная сера представляет собой желтую легкоподвижную жидкость, которая выше 160 °С превращается в очень вязкую темно-коричневую массу. Как видно из рис. 4, около 190 °С вязкость серы примерно в 9000 раз больше, чем при 160 °С. Затем она начинает уменьшаться, и выше 300 °С расплавленная сера, оставаясь темно-коричневой, вновь становится легко подвижной.
Изменений физических свойств при нагревании связано с изменением внутреннего строения серы. Выше 160 °С кольца S8 начинают разрываться, причем концевые атомы возникающих открытых структур сцепляются друг с другом, образуя цепи с длиной до миллиона атомов, что сопровождается резким повышением вязкости (и изменением цвета). Дальнейшее нагревание ведет к быстрому уменьшению средней длины цепей, вследствие чего вязкость уменьшается (хотя все же остается значительно большей, чем ниже 160 °С). Работа разрыва цепи оценивается в 138 кДж/моль.
Температура кипения серы (444,7 °С) является одной из вторичных стандартных точек международной шкалы. Теплота испарения серы составляет 9,2 кДж/моль. В парах имеет место равновесие главным образом между молекулами S8, S6, S4 и S2, причем переход от S8 к S2 осуществляется эндотермически:
1/4S8 (+4,4 кДж) ® 1/3S6 (+29 кДж) ®1/2S4 (+58 кДж) ® S2
Поэтому по мере повышения температуры равновесие все более смещается вправо. Внешним признаком этого служит изменение цвета паров, которые вблизи точки кипения имеют оранжево-желтую окраску, при дальнейшем нагревании сначала краснеют, а затем начинают бледнеть и при 650 °С становятся соломенно-желтыми. Пары кипящей серы содержат (по объему) приблизительно 59 % S8, 34 % S6, 4 % S4 и 3 % S2 с небольшими примесями нечетных молекул (S3, S5, S7). По видимому, все эти молекулы Sn (кроме S2) имеют циклическое строение. Около 900 °С пары серы состоят практически только из молекул S2 [с расстоянием d(SS) = 189 пм]. Энергия их диссоциации на атомы равна 418 кДж/моль и заметной она становится приблизительно с 1500 °С. Теплота атомизации серы (при 25 °С) равна 272 кДж/моль.
По электронному строению молекула S2 подобна молекуле О2. Магнитные свойства последней указывают на наличие в ней двух неспаренных электронов.
|
Рис. 5. Вероятное строение цепи Sm. |
Смотрите также
Атмосфера
...
Технология неконцентрированной азотной кислоты
Азотная
кислота по объему производства занимает среди других кислот второе место после
серной кислоты. Все возрастающий объем производства HNO3
объясняется огромным значением азотной кислот ...