Теория водородного атома
3. Поглощение и излучение атомом энергии имеет место только при п е р е с к о к е электрона с одной орбиты на другую. При этом разность энергий начального (Ео) и конечного (Ек) состояний воспринимается или отдается в виде кванта лучистой энергии (фотона), отвечающего излучению с частотой колебаний, определяемой рис. 111-22. Возможные соотношением hn = Eо - Eк.
Изложенные представления позволили вычислить радиусы различных “дозволенных” квантовыми условиями орбит электрона в атоме водорода. Оказалось, что они относятся друг к другу как 12:22:32:42: .:n2. Величина n была названа г л а в н ы м к в а н т о в ы м ч и с л о м. Как видно из приведенного выше, n может принимать различные значения, соответствующие натуральному ряду целых чисел.
Радиус ближайшей к ядру орбиты (n = 1) оказался для водорода равным 53 пм. Электрон вращается по ней со скоростью около 2200 км/с (средняя скорость вращения Земли вокруг Солнца составляет 30 км/с). На рис. III-22 дана схема возможных для атома водорода орбит, причем приведены лишь первые четыре. Скорость вращения электрона на второй из них вдвое меньше, чем на второй из них вдвое меньше,чем на первой, на третьей — втрое меньше и т. д. 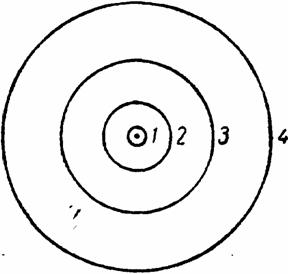
Рис. III-22. Возможные электронные орбиты атома водорода по Бору
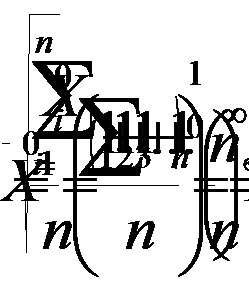
Рис. III-23. Схема происхождения водородного спектра
Работа, которую необходимо затратить для вырывания электрона водородного атома с той или иной орбиты, обратно пропорциональна квадрату ее главного квантового числа. Поэтому, например, вырвать электрон с третьей орбиты в девять раз легче, чем с первой.
Вычисленные частоты излучений, возникающих при перескоках электрона с одних орбит на другие, оказались совпадающими с частотами линий наблюдаемого на опыте водородного спектра. Как видно из рис. III-23, перескокам с различных более удаленных от ядра орбит на отвечающую n = 1 соответствуют линии серии, лежащей в ультрафиолетовой области, перескокам на орбиту с n = 2— линии серии Бальмера (рис. III-21), а перескокам на орбиты с n = 3, 4 и 5 — линии трех серий, лежащих в инфракрасной области. Две последние серии были обнаружены экспериментально уже после разработки теории водородного атома и именно на основе ее предсказаний.
5-6
Если сообщить водородному атому достаточную энергию, то происходит его ионизация — распад на электрон и протон. Энергия, которую нужно для этого затратить, отвечает n = ¥ (рис. III -24) и называется энергией ионизации (I). Она определена из спектра и для нормального состояния атома водорода составляет 1311 кДж на моль.
Н + 1311 кДж = Н+ + е
По соотношению I = 1311/n2 энергия ионизации может быть рассчитана и для возбужденных состояний атома водорода.
7
Дальнейшее развитие теории водородного атома было дано Зоммерфельдом (1916 г.), показавшим, что кроме круговых орбит электрон может двигаться и по эллиптическим (с ядром в одном из фокусов эллипса), причем почти одинаковому уровню энергии соответствует столько возможных типов орбит, сколько единиц в главном квантовом числе. Последнее определяет размер большой полуоси данного семейства эллипсов (в частном случае круга его радиус). Величина малой полуоси определяется “п о б о ч н ы м” квантовым числом (6), которое также принимает значения последовательных целых чисел, но не может быть больше главного.
Смотрите также
Структура процесса обслуживания официантами
Метод обслуживания официантами применяется в ресторанах, кафе и закусочных первой и высшей категории, а также в некоторых столовых. Структура процесса обслуживания официантами состоит из двух стадий: ...
Белки, их строение и состав
БЕЛКИ — это азотсодержащие
высокомолекулярные органические вещества со сложным составом и строением молекул.
Белок можно
рассматривать как сложный полимер аминокислот.
Белки входят в
...
