Общие свойства лантаноидов
Лантаноиды – это 14 элементов, следующих за лантаном, у которых к электронной конфигурации лантана последовательно добавляются 14 4f-электронов. В табл. 2.1 приведены электронные конфигурации лантаноидов и их наиболее устойчивые степени окисления. Общая электронная конфигурация лантаноидов – 4f2–145d0–16s2.
У церия на 4f-уровне находятся два электрона – один за счет увеличения порядкового номера по сравнению с лантаном на единицу, а другой переходит с 5d-уровня на 4f. До гадолиния происходит последовательное увеличение числа электронов на 4f-уровне, а уровень 5d остается незанятым. У гадолиния дополнительный электрон занимает 5d-уровень, давая электронную конфигурацию 4f75d16s2, а у следующего за гадолинием тербия происходит, аналогично церию, переход 5d-электрона на 4f-уровень (4f96s2). Далее до иттербия наблюдается монотонное увеличение числа электронов до 4f14, а у завершающего ряд лютеция вновь появляется 5d-электрон (4f145d16s2).
Таблица 2.1
|
Электронная конфигурация и степени окисления лантаноидов | |||
|
Элемент |
Электронная конфигурация |
Степень окисления | |
|
Церий |
Ce |
4f26s2 |
+3, +4 |
|
Празеодим |
Pr |
4f36s2 |
+3, +4 |
|
Неодим |
Nd |
4f46s2 |
+3 |
|
Прометий |
Pm |
4f56s2 |
+3 |
|
Самарий |
Sm |
4f66s2 |
+2, +3 |
|
Европий |
Eu |
4f76s2 |
+2, +3 |
|
Гадолиний |
Gd |
4f75d16s2 |
+3 |
|
Тербий |
Tb |
4f96s2 |
+3, +4 |
|
Диспрозий |
Dy |
4f106s2 |
+3, +4 |
|
Гольмий |
Ho |
4f116s2 |
+3 |
|
Эрбий |
Er |
4f126s2 |
+3 |
|
Тулий |
Tm |
4f136s2 |
+2, +3 |
|
Иттербий |
Yb |
4f146s2 |
+2, +3 |
|
Лютеций |
Lu |
4f145d16s2 |
+3 |
Периодический характер заполнения 4f-орбиталей сначала по одному, а потом по два электрона предопределяет внутреннюю периодичность свойств лантаноидов. Периодически изменяются металлические радиусы, степени окисления, температуры плавления и кипения, величины магнитных моментов, окраска и другие свойства (Рис. 2.1).
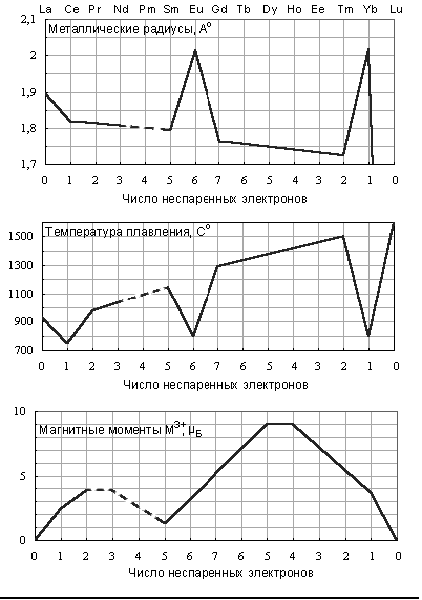
Вторичная периодическая зависимость металлических радиусов, температуры плавления и магнитного момента
Рис. 2.1
Участие 4f-электронов в образовании химической связи обусловлено предварительным возбуждением на уровень 5d. Энергия возбуждения одного электрона невелика, поэтому обычно лантаноиды проявляют степень окисления +3. Однако некоторые из них проявляют так называемые аномальные степени окисления – +2, +4. Эти состояния окисления связывают с образованием наиболее устойчивых электронных конфигураций 4f0, 4f7, 4f14. Так, Ce и Tb приобретают конфигурации f0 и f7, переходя в состояние окисления +4, тогда как Eu и Yb имеют соответственно конфигурации – f7 и f14 в состоянии окисления +2. Однако существование Pr (IV), Sm (II), Dy (IV) и Tm (II) свидетельствует об относительности критерия особой устойчивости электронных конфигураций 4f0, 4f7 и 4f14. Как и для d-элементов, стабильность состояния окисления наряду с этим фактором характеризуется термодинамическими параметрами реального соединения.
Смотрите также
Охрана труда сегодня, как никогда, актуальна
Опыт крупнейших мировых компаний показывает, что охрану труда высшие руководители считают одним из главных приоритетов. Так, из десятков показателей деятельности предприятия охрану труда и здоровья св ...
Синтезы органических соединений на основе оксида углерода
Помимо синтезов органических соединений из СО и Н2
– углеводороды, олефины, в том числе изобутилен с высокими показателями
(селективность > 90%), спирты, в том числе изобутанол с выходом ...
Введение
В настоящее время развитие
производств, применяющих смесь азотной и серных кислот в качестве нитрующего
агента, привело к получению огромных количеств отработанных кислотных смесей.
Эти смеси с эк ...
