Расчет материального баланса процесса получения метанола, интенсивности работы катализатора, часовой производительности установки.
В результате процесса происходят следующие процессы:
1) СО + 2Н2 = СН3ОН + Q
2) СО + 3Н2 = СН4 + Н2О
3) 2СО + 2Н2 = СН4 + СО2
4) 2СО = СО2 + С
5) СО + Н2 = НСНО
6) 2СН3ОН = (СН3)2О + Н2О
7) СН3ОН + Н2 = СН4 + Н2О
Данные для расчета:
1. Рабочий объем катализатора – 24 м3.
2. Расход окиси углерода и метанола на побочные продукты:
СО СН3О
Реакция 2 – 3,8 Реакция 6 – 1,9
Реакция 3 – 4,1 Реакция 7 – 0,5
Реакция 4 – 2,5
Реакция 5 – 0,7
Температура Т = 643 К
Давление Р = 36,5 МПа
Объемная скорость ![]()
Мольное соотношение Н2 : СО = 6,2 : 1
3. База для расчета – 1 час работы установки.
Решение:
1. Рассчитаем объем синтез-газа, подаваемый за 1 час в реактор.
Пересчитаем объем газа из нормальных условий в условия реактора:
![]()
где р, V, Т – соответственно давление, объем при данной температуре,
р0, V0 – давление и объем при нормальных условиях.
Отсюда
![]()
![]()
Тогда учитывая объем катализатора, объем синтез-газа будет равен:
![]() м3/ч
м3/ч
2. Зная мольные отношения, определим массы Н2 и СО2, подаваемые в реактор за 1 час.
Зная, что при нормальных условиях 1 моль любого газа занимает объем 22,4 л (0, 224 м3), определим количество молей водорода и оксида углерода:
![]() моль
моль
Тогда количества молей газов составят:
![]() моль/ч
моль/ч
![]() моль/ч
моль/ч
Массовый расход водорода составит
![]() 26,57 · 106 · 2 = 53,14 · 106 г/ч = 53,14 · 103 кг/ч
26,57 · 106 · 2 = 53,14 · 106 г/ч = 53,14 · 103 кг/ч
![]() 4,29 · 106 · 28 = 120 · 106 г/ч = 120 · 103 кг/ч
4,29 · 106 · 28 = 120 · 106 г/ч = 120 · 103 кг/ч
3. Расход окиси углерода на побочные и прямую реакции составит:
На реакцию 2 m (СО) = 120000 · 0,038 = 4560 кг/ч
На реакцию 3 m (СО) = 120000 · 0,041 = 4920 кг/ч
На реакцию 4 m (СО) = 120000 · 0,025 = 3000 кг/ч
На реакцию 5 m (СО) = 120000 · 0,007 = 840 кг/ч
Тогда на прямую реакцию будет израсходовано СО:
m (СО) = 120000 - 4560 – 4920 – 3000 – 840 = 106 680 кг/ч
4. Рассчитаем массу метанола исходя из уравнения реакции (1):
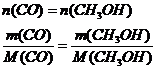
![]() кг/ч
кг/ч
5. Рассчитаем массу метанола, реагирующего по побочным реакциям и метанола, полученного в виде продукта:
На реакцию 6 m(СН3ОН) = 121 920 · 0,019 = 2316,5 кг/ч
На реакцию 7 m(СН3ОН) = 121 920 · 0,005 = 609,6 кг/ч
Тогда в качестве продукта будет получено метанола:
m(СН3ОН) = 121920 – 2316,5 - 609,6 = 118993,9 кг/ч
6.Проведем балансовые расчеты по основной и побочным реакциям:
Реакция 1:
Расход водорода составит:
![]() кг/ч
кг/ч
Реакция 2:
Расход водорода составит:
![]() 977,1 кг/ч
977,1 кг/ч
будет получено метана:
![]() кг/ч
кг/ч
будет получено воды:
![]()
Реакция 3:
Расход водорода составит:
![]() кг/ч
кг/ч
Смотрите также
Химические способы очистки поверхностей полупроводниковых пластин
Современный этап развития радиоэлектроники
характеризуется широким применением интегральных микросхем (ИМС) во всех
радиотехнических системах и аппаратуре. Это связано со значительным усложн ...
Химия запахов
Почти 2000 лет назад античный учёный, поэт
и философ Тит Лукреций Кар полагал, что в носовой полости есть крошечные поры
разных размера и формы. Каждое пахучее вещество,
рассуждал он, испус ...
Пищевые жиры
...
