Синтез 5-ацетил-N,3,6-триметилиндазола и его производных на основе 2,4-диацетил-N,5-диметиланилина
Ранее было показано [1,2], что рециклизация 3,5-диацетилпиридиниевой соли (I) под действием водно-спиртовой щелочи приводит к получению 2,4-диацетил-N,5-диметиланилина (II) с выходом 85% (схема 1).
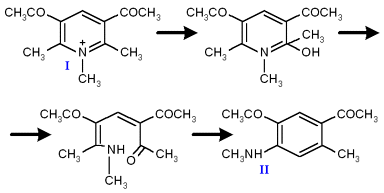
Схема 1:
Аминодикетон (II) испытан на биологическую активность, в результате чего была обнаружена его фунгицидная активность (100% подавление гриба биполярис). Однако, он не может быть конкурентом известному и используемому в настоящее время препарату фурацилин.
Цель настоящей работы - использование полифункциональности аминодикетона II в синтезе новых соединений на его основе с последующим испытанием их на биологическую активность.
На схеме 2 представлены реализованные нами пути синтеза новых соединений (III-X).
Нитрозированием аминодикетона II нитритом натрия в уксусной кислоте и последующим восстановлением нитрозопроизводного V цинковой пылью был получен 5-ацетил-N,3,6-триметилиндазол (VI). Обе стадии синтеза проходят в мягких условиях и с высоким выходом.
Ацилирование 5-ацетилиндазола VI диэтилоксалатом приводит к получению этилового эфира (N,3,6-триметилиндазоил-5)пировиноградной кислоты (X).
Реакцию Манниха проводили нагреванием 5 - ацетилиндазола VI с параформом и гидрохлоридом диметиламина в диоксане. Аминометилирование соединения VI в этаноле идет с низким выходом, а в диоксане выход гидрохлорида N,3,5-триметил-5-(b-аминодиметилпропионил)индазола (VII) составил 96%.
Перегруппировку Бекмана кетоксима VIII осуществляли под действием PCl5 в абс. эфире. Выход ацетаминоиндазола IX 56%.
Исходный кетоксим VIII получен с количественным выходом нагреванием 5-ацетилиндазола с гидрохлоридом гидроксиламина в абсолютном этаноле в присутствии пиридина.
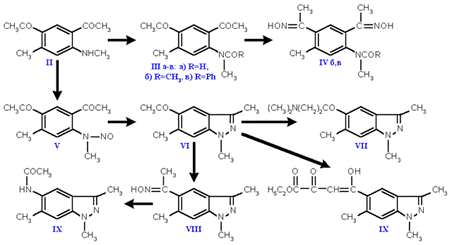
Схема 2:
Таблица 1: ХАРАКТЕРИСТИКИ СИНТЕЗИРОВАННЫХ СОЕДИНЕНИЙ
|
Cое- дине- ние |
Брутто формула |
Тпл., 27°С |
Спектры ПМР d, м.д. (CDCl3) (VII и IX в D6-ДМСО) |
ИК-сп, n, cм-1 |
Вы- ход % |
|
IIIа |
C13H15NO3 |
87-88 |
2.49 (3H, c, CH3-Ar); 2.59 (3H, c, COCH3); 2.62 (3H, c, COCH3); 3.29 (3H, c, N-CH3); 7.13 (1H, c, 6-H); 8.03 (1H, c, 3-H); 8.14 (1H, c, CHO) |
1620 1700 |
80 |
|
IIIб |
C14H17NO3 |
134-135 |
1.82 (3H, c, NCOCH3); 2.54 (3H, c, CH3-Ar); 2.59 (3H, c, COCH3; 2.05 (3H, c, COCH3); 3.22 (3H, c, N-CH3); 7.15 (1H, c, 6-H); 8.10 (1H, c, 3-H) |
1660 1700 |
85 |
|
IIIв |
C19H19NO3 |
134,5-136 |
2.27 (3H, c, CH3-Ar); 2.56 (6H, c, 2COCH3); 3.47 (3H, c, N-CH3); 7.21-7.27 (6H, м, Ph и 6-H); 7.80 (1H, c, 3-H) |
1660 1690 |
97 |
|
V |
C12H14N2O3 |
94-95,5 |
2.76 (3H, c, CH3-Ar); 3.03 (6H, c, 2CH3CO); 3.88 (3H, c, CH3-N); 7.70 (1H, c, 6-H); 8.46 (1H, c, 3-H) |
1490 1705 |
88 |
|
VI |
C12H14N2O |
126-127 |
2.80 (3H, c, 3-CH3); 2.86 (3H, c, 5-CH3); 2.90 (6H, c, 2CH3CO); 4.23 (3H, c, CH3-N); 7.3 (1H, c, 7-H); 8.28 (1H, c, 4-H) |
1690 |
74 |
|
VII |
C15H22ClN3O |
181-182 |
2.34 (3H, c, 3-CH3); 2.39 (3H, c, 6-CH3); 2.61 (6H, c, (CH3)2N); 3.36 (2H, т, J=9Гц, CH3-N); 3.44 (2H, т, CH2CO); 3.75 (3H, c, CH3-N); 7.24 (1H, c, 7-H); 8.26 (1H, c, 4-H) |
1665 2600 |
67 |
|
IX |
C12H15N3O |
212-213 |
1.89 (3H,c, CH3CO); 2.15 (3H, c, 3-CH3); 2.42 (3H, c, 6-CH3); 3.74 (3H, c, CH3-N); 7.20 (1H, c, 7-H); 7.41 (1H, c, 4-H); 9.09 (1H, c, NH) |
1680 3400 |
58 |
|
X |
C16H18N2O4 |
103-105 |
1.43 (3H, т, J=7.4Гц, CH3); 2.60 (3H, c, 3-CH3); 2.70 (3H, c, 6-CH3); 3.99 (3H, c, CH3-N); 4.40 (2H, к, CH2); 6.99 (1H, c, =CH-OH); 7.16 (1H, c, 7-H); 8.05 (1H, c, 4-H) |
1620 1730 |
63 |
Смотрите также
Климатические воздействия и их характеристики. Радиационные воздействия их характеристика
...
Кислотные дожди
Термином "кислотные дожди" называют
все виды метеорологических осадков - дождь, снег, град, туман, дождь со снегом,
- рН которых меньше, чем среднее значение рН дождевой воды (сред ...
Введение
В настоящее время развитие
производств, применяющих смесь азотной и серных кислот в качестве нитрующего
агента, привело к получению огромных количеств отработанных кислотных смесей.
Эти смеси с эк ...
