23. Буферные системы крови.Плазма крови
Большое значение буферные системы имеют в под–держании кислотно-основного равновесия организмов. Внутриклеточные и внеклеточные жидкости всех живых организмов характеризуются постоянным значением рН, которое поддерживается с помощью буферных систем. Значение рН большей части внутриклеточных жидко–стей находится в интервале от 6,8 до 7,8.
Кислотно-основное равновесие КО-равновесия в крови человека обеспечивается водород-карбонатной, фосфат–ной и белковой буферными системами.
Нормальное значение рН плазмы крови составляет 7,40 ± 0 05. Этому соответствует интервал значений активной кислотности от 3,7 до 4,0х10-8 моль/л. Так как в крови присутствуют различные электролиты (HC03 –, H2CO3 , Н2РО4 –, НРО42- ), белки, аминокислоты, это озна–чает, что они диссоциируют в такой степени, чтобы ак–тивность а(Н+) находилась в указанном интервале.
В связи с тем что содержание неорганических и ор–ганических веществ в плазме и клетках крови неоди–наково, целесообразно рассмотреть эти составляющие крови отдельно.
Плазма крови
Водород-карбонатная буферная система НСО3 –/ Н2СО3 состоит из угольной кислоты Н2СО3 и сопряжен–ного основания НСО3 –. Это наиболее важная буфер–ная система крови. Одим из компонентов – угольная кислота Н2СО3 – образуется при взаимодействии раст–воренного в плазме СО2 с водой:
СО2(р) + Н2О н Н2СО3.
где СО2(р) – концентрация растворенного СО2 .
Константа равновесия этой реакции:
К = [Н2СО3] / [СО2]
Между СО2 в альвеолах и водород-карбонатным буфером в плазме крови, протекающей через ка–пилляры легких, устанавливается цепочка равновесий.
Водород-карбонатная буферная система действует как эффективный физиологический буферный раствор вблизи рН7,4.
При поступлении в кровь кислот – доноров Н+ равно–весие в цепочке по принципу Ле Шателье смещается влево в результате того, что ионы НСО3 связывают ионы Н в молекулы Н2СО3 . При этом концентрация Н2СО3 по–вышается, а концентрация ионов НСО3 понижается. По–вышение концентрации Н2СО3 приводит к смещению равновесия влево, (принцип Ле Шателье). Это вызывает распад Н2СО3 и увеличение концентрации СО2 , раство–ренного в плазме. В результате смещается равновесие влево и повышается давление СО2 в легких. Избыток СО2 выводится из организма.
В результате водород-карбонатная система крови быстро приходит в равновесие с СO2 в альвеолах и эф–фективно обеспечивает поддержание постоянства рН плазмы крови. 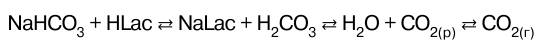
Таким образом, поддерживается нормальное зна–чение рН крови при слабо выраженном сдвиге рН, об–условленном ацидозом.
В замкнутых помещениях часто испытывают удушье (нехватку кислорода), учащение дыхания. Однако удушье связано не столько с недостатком кислорода, сколько с избытком СО2 .
Избыток СO2 в атмосфере согласно закону Генри при–водит к дополнительному растворению СO2 в крови. А это приводит к понижению рН крови, т. е. к ацидозу.
Водород-карбонатная буферная система наиболее быстро отзывается на изменение рН крови. Ее буферная емкость по кислоте составляет Вк = 40 ммоль/л плазмы крови, а буферная емкость по щелочи значительно мень–ше и равна примерно Вщ = 1—2 ммоль/л плазмы крови.
Смотрите также
Витамины и организм человека
Витамины – низкомолекулярные органические соединения различной
химической природы, необходимые для осуществления важнейших процессов,
протекающих в живом организме.
Для нормальной
жизнед ...
Современные и перспективные требования и технологии к качеству
тяжелых моторных и судового маловязкого топлива
Настоящие
технические условия распространяются на топливо маловязкое судовое получаемое
из дистиллятных фракций прямой перегонки и вторичной переработки нефти.
Топливо
маловязкое судов ...
