Периодический закон и периодическая система химических элементов Д. И. Менделеева
Периодический закон открыт Д. И. Менделеевым в 1869 году, за основу классификации Менделеев принял атомные массы элементов. Современная формулировка закона: Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер этих элементов
.
Свойства элементов повторяются периодически, так как периодически повторяется строение внешнего энергетического уровня атомов.
Графическим изображением периодического закона является периодическая таблица. Порядковый номер элемента в периодической таблице соответствует величине заряда ядра атома и количеству электронов в атоме.
Таблица семи периодов: три малых и четыре больших. Периоды – это ряды элементов расположенных в порядке возрастания порядковых номеров, начинающихся щелочным металлом и заканчивающийся инертным газом. 1 – 3 периоды малые (2, 8, 8 элементов). В малых периодах накопление электронов с возрастанием порядкового номера происходит на внешнем уровне.
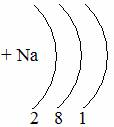
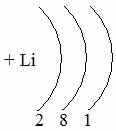
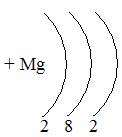
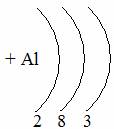
4 – 6 периоды большие. В больших периодах с возрастанием порядкового номера накопление на внешнем уровне происходит у элементов первой, второй группы. Начиная с элемента третьей группы электроны, накапливаются на предпоследнем уровне до 18-ти, а затем возобновляется достройка внешнего уровня до 8-ми электронов.
Большие периоды состоят из двух рядов: чётного и нечётного. Чётные ряды составляют только металлы (1-2 электрона, Cr – 2). В нечётном ряду металлы и неметаллы (1-8 электронов на внешнем уровне).
Металлические свойства в периоде с возрастанием порядкового номера элемента ослабевают, а неметаллические усиливаются, так как радиус атома уменьшается.
Седьмой период не завершён.
Номер периода показывает число энергетических уровней в атоме.
В таблице 8 групп. Группы – это элементы, объединённые в одном вертикальном столбце таблицы. Группы делятся на две подгруппы, в которых объединены элементы со сходным строением внешнего энергетического уровня. В главных подгруппах находятся элементы больших и малых периодов – это s- и p-элементы (заполняются соответственно s- и p-подуровни). В побочных подгруппах находятся элементы только больших периодов f- и d-подуровней (f – лантаноиды и актиноиды). В главных подгруппах расположены металлы и неметаллы. В побочных подгруппах расположены только металлы. Валентные электроны у элементов главной подгруппы расположены в наружном слое. У элементов побочных подгрупп валентные электроны расположены на внешнем и предпоследнем уровне.
Металлические свойства в группе с увеличением порядкового номера элемента усиливаются, так как увеличивается радиус атома. Номер группы показывает высшую валентность элемента и количество электронов на внешнем уровне у элементов главной подгруппы. Элементы побочных подгрупп на внешнем уровне имеют, как правило, один или два электрона.
