Влияние температуры.
Для того, чтобы исходные вещесива (реагенты) достигли переходного состояния (превратились в активированный комплекс) система должна получить определенное количество энергии, называемое энергией активизации.
Энергия активизации, входящая в уравнение Аррениуса, представляет собой разность между средней энергией реагирующих частиц и энергией активированного комплекса.
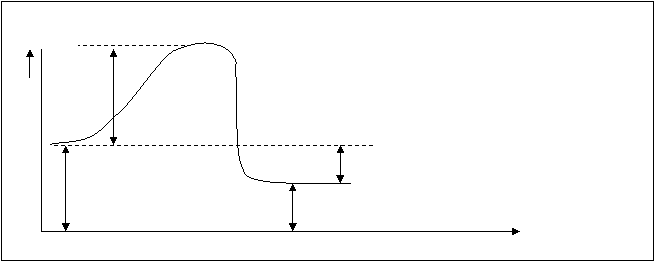 Энергия активизации – своя величина для каждого процесса, это значит, что она является характеристической величиной конкретной реакции можно сказать, что она определяет влияние на скорость химической реакции природы реагирующих веществ. Если сравнивать энергию активизации и энергию диссоциации веществ, то энергия активизации по величине меньше, чем энергия диссоциации наименее прочной связи в молекулах реагирующих веществ. На следующей энергетической схеме для экзотермической реакции А+В=АВ (рис.10.4.) дано соотношение между величиной различных энергий.
Энергия активизации – своя величина для каждого процесса, это значит, что она является характеристической величиной конкретной реакции можно сказать, что она определяет влияние на скорость химической реакции природы реагирующих веществ. Если сравнивать энергию активизации и энергию диссоциации веществ, то энергия активизации по величине меньше, чем энергия диссоциации наименее прочной связи в молекулах реагирующих веществ. На следующей энергетической схеме для экзотермической реакции А+В=АВ (рис.10.4.) дано соотношение между величиной различных энергий.
Активированый
комплекс
Н А…В
Е
А+В
ΔН реакции
Σ Н реагентов
Σ Н продукты реакции
путь реакции
Рис.10.4. Энергетическая схема хода реакции А+В=Д
Активация молекул может быть осуществлена при нагревании или растворении вещества, при выделении энергии в ходе самой реакции, при поглощении ими квантов светового, радиоактивного, рентгеновского или другого излучения, под действием ультрозвука, электрического разряда и даже при ударе о стенку сосуда.
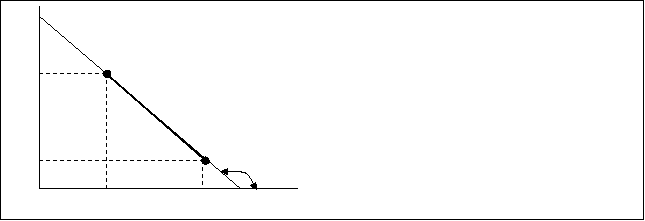 По теории Аррениуса зависимость ln”K” от 1/Т имеет линейный характер (рис.10.5.)
По теории Аррениуса зависимость ln”K” от 1/Т имеет линейный характер (рис.10.5.)
lnK
lnK2
Рис.10.5. Зависимость lnK от 1/Т
lnK1 α
0
1/T1 1/T2 1/T
![]() Исходя из графической зависимости lnK от 1/Т можно расчитать энергию активации.
Исходя из графической зависимости lnK от 1/Т можно расчитать энергию активации.
Е=Rtgα
Это значит, что энергию активации можно определять из анализа экспериментальных данных по зависимости скорости реакции от температуры.
По закону действующих масс скорость реакции А+В=АВ выражается следующим кинетическим уравнением:
V=K[A][B]
Выражение К определяем из соотношения Аррениуса:
К=А*е–Е/RT
и подставляем в кинетическое уравнение реакции:
V= А*е–Е/RT[а][в]
Произведем замену величины А[а][в] на Z и получаем значение:
V=Z*е–Е/RT
Прологарифмировав это выражение, будем иметь уравнение:
lgV=lgZ – (E/RT)lge=lgZ – (0,434E/R)*1/T
lgV= -(0,434E/R)*1/T
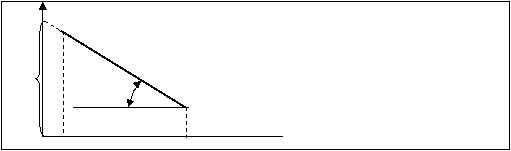
которое является уравнением прямой в координатах lgV и 1/T, как это представлено на рис.10.5.
 lgV
lgV
lgZ Рис.10.5.
β
1/T
Из графика (рис.10.5.) определяют тангенс угла β:
tgβ=lgV/(1/T) = ((-0,434E/R)*(1/T))/1/T = -0,434E/R
Последнее выражение позволяет определить энергию активации Е
Е= -tgβR/0,434
Смотрите также
Синтез метанола
...
Бром
БРОМ (лат. Bromum), Br - химический
элемент VII группы периодической
системы Менделеева, относится к галогенам, атомный номер 35, атомная
масса 79,904; красно-бурая жидкость с сильным не ...
Расчет численности работающих.
Численность
трудящихся проектируемого объема рассчитывается по категориям и группам
работников: основные рабочие, вспомогательные рабочие (включая дежурный и
ремонтный персонал), инженерно-техничес ...
