Донорно – акцепторная связь.
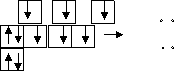 Рассматривая ковалентную связь, выяснили, что она образуется в результате перекрывания одноэлектронных валентных облаков взаимодействующих атомов. Так, атом азота взаимодействует тремя одноэлектронными облаками, например, с тремя атомами водорода, образуя молекулу аммиака NH3. H
Рассматривая ковалентную связь, выяснили, что она образуется в результате перекрывания одноэлектронных валентных облаков взаимодействующих атомов. Так, атом азота взаимодействует тремя одноэлектронными облаками, например, с тремя атомами водорода, образуя молекулу аммиака NH3. H
H:N:
H
Но атом азота имеет на внешнем квантовом уровне еще два электрона, расположенных на 2s-подуровне, и для их распаривания у атома возможности нет. Возникает вопрос: может ли пара электронов, находящихся на 2s-орбитале, образовывать химическую связь? Оказывается, что может. Но для этого нужны определенные условия, а именно, наличие свободной орбитали.
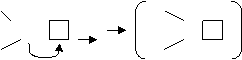
Такое взаимодействие, т.е. взаимодействие за счет пары электронов (ее называют “неподеленной”) одного атома и свободной орбитали другого атома называют донорно-акцепторным, а химическую связь, образованную при помощи этого взаимодействия – донорно – акцепторной связью.
Следовательно, необходимым условием для образования донорно – акцепторной связи, является наличие неподеленной электронной пары одного атома (молекулы) и свободной орбитали другого атома (молекулы). Неподеленная пара донора занимает свободную орбиталь акцептора. Образуется двухэлектронная орбиталь, которая обслуживает оба атома (атом донора и атом акцептора).
Если обратиться к аммиаку, то молекула NH3 может образовывать донорно – акцепторную связью с любой другой молекулой, у которой атомы имеют свободные орбитали.
 Например, NH3 легко взаимодействует с молекулой HCl. В полярной молекуле HCl общая электронная пара (область перекрывания орбиталей) сильно смещена в сторону более электроотрицательного атома хлора. При этом орбиталь атома водорода практически свободна и она может принимать электронную пару донора (атома азота) образуя дополнительную связь. H H
Например, NH3 легко взаимодействует с молекулой HCl. В полярной молекуле HCl общая электронная пара (область перекрывания орбиталей) сильно смещена в сторону более электроотрицательного атома хлора. При этом орбиталь атома водорода практически свободна и она может принимать электронную пару донора (атома азота) образуя дополнительную связь. H H
H – N: + H:Cl H – N : H Cl
H H
В результате донорно – акцепторного взаимодействия двух нейтральных молекул NH3 и HCl получается новое соединение – хлорид аммония.
NH3+HCl = NH4Cl.
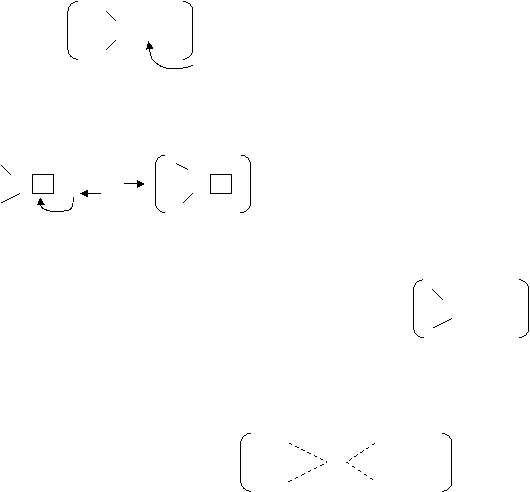 Хлорид аммония – ионное соединение. Донорно – акцепторное взаимодействие превратило молекулу аммиака в ион аммония NH4+. В ионе аммония три водорода связаны с азотом по ковалентному принципу, а четвертый водород – по донорно – акцепторному. H +
Хлорид аммония – ионное соединение. Донорно – акцепторное взаимодействие превратило молекулу аммиака в ион аммония NH4+. В ионе аммония три водорода связаны с азотом по ковалентному принципу, а четвертый водород – по донорно – акцепторному. H +
H – N– – –H
H донорно – акцепторная связь.
Донорно – акцепторную связь обычно обозначают пунктирной линией (– – –).
По донорно – акцепторному принципу легко взаимодействуют такие две нейтральные молекулы: BF3 и HF. У бора есть свободная орбиталь на 2р-подуровне, а у фтора неподеленная пара электронов. Бор является акцептором, а фтор донором.
F F –
F – B + :F - H F – B : F H+. Образуется сложный (комплексный)
F F анион [BF4]–.
Новая более сложная молекула Н[BF4] вобрала в себя три вида связей: между комплексным анионом BF4– и катионом H+ – ионная связь. В анионе BF4– три фтора соединены с бором по ковалентному принципу, а четвертый фтор – связан с бором посредством донорно – акцепторного взаимодействия. F –
F – B – – – F
F
Как видно из рассмотренных примеров донорно – акцепторная связь объединяет простые молекулы в комплексы. Например, ZnSO4 легко взаимодействует с аммиаком с образованием комплексного соединения – сульфата тетраамминцинка.
ZnSO4 + 4NH3 = [Zn(NH3) 4]SO4
H3N NH3 2+
Zn2+ + 4NH3 = Zn
H3N NH3
Наряду с межмолекулярной, донорно – акцепторная связь иногда встречается как дополнительная связь внутри одной молекулы (внутримолекулярная)
Рассмотрим два примера:
Молекула СО.
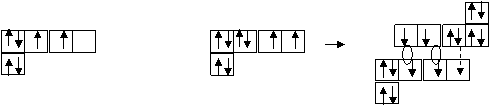 В невозбужденном состоянии атом углерода имеет два неспаренных электрона на р–подуровне и свободную р–орбиталь. Атом кислорода на р–подуровне содержит два неспаренных электрона и одну электронную пару.
В невозбужденном состоянии атом углерода имеет два неспаренных электрона на р–подуровне и свободную р–орбиталь. Атом кислорода на р–подуровне содержит два неспаренных электрона и одну электронную пару.
С + O O
s
p C
Неспаренные электроны углерода и кислорода образуют в молекуле СО две дополнительных s– и p–связи и одну донорно – акцепторную – за счет неспаренной электронной пары кислорода (донор) и свободной орбитали углерода (акцептор).
Смотрите также
Кефир
Кисломолочные продукты - это продукты,
вырабатываемые сквашиванием молока или сливок чистыми культурами молочнокислых
бактерий с добавлением или без добавления дрожжей или уксуснокислых бакт ...
Жизнь и деятельность Д.И. Менделеева. Периодический закон
Периодический
закон и Периодическая система химических элементов Д.И. Менделеева – основа
современной химии. Да и остальные открытия ученого по сей день не потеряли
своего значения.
Дмит ...
