Условия равновесия в многокомпонентных гетерогенных системах.
Пусть р, Т = Const, тогда ![]() . Если в системе имеются фазы (') и (''), то при переходе dni молей i –ого компонента из фазы (') в фазу ('') изменение энергии Гиббса системы dG будет складываться из изменении энергий Гиббса обеих фаз dG ' и dG '':
. Если в системе имеются фазы (') и (''), то при переходе dni молей i –ого компонента из фазы (') в фазу ('') изменение энергии Гиббса системы dG будет складываться из изменении энергий Гиббса обеих фаз dG ' и dG '': ![]() .
.
Если система закрытая, то 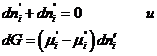 , а если она к тому же и равновесна, то dG = 0 и, следовательно,
, а если она к тому же и равновесна, то dG = 0 и, следовательно, ![]() , т.е. химические потенциалы данного компонента во всех фазах системы, находящейся в равновесии, равны между собой.
, т.е. химические потенциалы данного компонента во всех фазах системы, находящейся в равновесии, равны между собой.
Самопроизвольный неравновесный процесс может идти только в сторону уменьшения энергии Гиббса системы dG < 0 (p, T = const).
Предположим, что ![]() , т.е. фаза (') теряет i –ый компонент, но
, т.е. фаза (') теряет i –ый компонент, но ![]() , значит
, значит ![]() .
.
Если же ![]() , тогда
, тогда ![]() . Таким образом, компонент самопроизвольно переходит из фазы, в которой его химический потенциал больше, в фазу, в которой его химический потенциал меньше.
. Таким образом, компонент самопроизвольно переходит из фазы, в которой его химический потенциал больше, в фазу, в которой его химический потенциал меньше.
Эти условия равновесия и самопроизвольности процессов переноса вещества в многокомпонентных системах являются обобщением таковых для однокомпонентных систем (см. гл. 6). Кроме того, легко заметить, что химический потенциал чистого вещества равен его мольной энергии Гиббса.
Смотрите также
Спирт
...
Этапы определения АК последовательности в пептидах. Синтез белка
Предварительное
освобождение каждого анализируемого пептида от примесей других.
1.
Идентификация NH2- и СООН - концевых остатков.
2.
Расщепление с помощью трипсина неповрежденной цепи ...
Расчет сметной стоимости проектируемого объекта
Капитальные
вложения в проектируемый объект принято называть полной сметной стоимостью
этого объекта. В проектных организациях расчет капитальных затрат
осуществляется путем составления локальных с ...
