Качественные сведения о химической связи
Простейшая одноэлектронная двуцентровая связь Молекулярный ион водорода
Максимальное число возможных в природе различных химических связей между парами атомов AB, AC, . MN, . представим как число всех парных сочетаний из 105 атомов, образующих Периодическую Систему Менделеева.
Число сочетаний по n элементов, образуемых из m объектов, как известно, равно
![]() .
.
Если ограничиться лишь нейтральными состояниями молекул, а ионизированные состояния не считать отдельными самостоятельными частицами, то число всех возможных двухатомных комбинаций равно всего лишь:
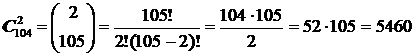
На самом деле не всякое двухатомное образование может быть устойчивой молекулой; лишь их часть обладает признаками устойчивых химических связей, но их точное количество для начала не столь уж и важно. Намного важнее то, что оно в принципе ограничено. Оно сравнительно велико, но нет сомнения, что важнейшие качественные и количественные признаки химических связей могут быть систематизированы на основе последовательно развиваемой теории электронно-ядерных взаимодействий.
Круг довольно специфических физических явлений, приводящих к образованию химических связей, составляет предмет теории валентности.
Атом это одноцентровая система всего с одним ядром. В оболочке простейшего атома - атома водорода (или водородоподобного иона) содержится всего один электрон. У нейтрального многоэлектронного атома в оболочке содержится Z электронов, а у иона имеется избыточный положительный или отрицательный заряд. Число электронов в оболочке либо менее (у катиона), либо более (у аниона) на величину избыточного заряда.
Молекула - система и многоцентровая (многоядерная), и многоэлектронная.
В ядерном остове двухатомных молекул – всего два ядра. Двухатомные молекулы могут быть гомоядерными (если оба ядра одинаковы) или гетероядерными (если ядра различны).
И в том, и в другом случае двухатомная молекула представляет самостоятельный интерес и как устойчивая физическая система, и как простейший пример идеальной валентности -химической связи, возникающая между парой атомов одного либо двух элементов.
Минимальное число электронов, которое можно себе представить в электронной оболочке молекулы, как и в атоме, - всего один. Однако не у всех молекул, и в первую очередь, у тех, что образованы из атомов тяжёлых элементов, этого достатоточно для обеспечения стабильности молекулярной структуры.
Простейшая молекула содержит лишь два простейших ядра - два протона, и электрон у неё всего один. Это молекулярный ион водорода ![]() . Существуют его изотоп - замещённые аналоги, например, симметричный катион дидейтерия
. Существуют его изотоп - замещённые аналоги, например, симметричный катион дидейтерия ![]() , или асимметричный катион дейтероводорода
, или асимметричный катион дейтероводорода ![]() , или молекулярный ион дитрития
, или молекулярный ион дитрития ![]() и т.д Электронные оболочки всех этих частиц почти одинаковы, поскольку их строение определяется лишь зарядами ядер, а они-то одинаковы. Основными характеристиками химической связи являются её длина и её энергия диссоциации. Их разница равна остаточной колебательной энергии, а квант вибрационного возбуждения вдвое больше.
и т.д Электронные оболочки всех этих частиц почти одинаковы, поскольку их строение определяется лишь зарядами ядер, а они-то одинаковы. Основными характеристиками химической связи являются её длина и её энергия диссоциации. Их разница равна остаточной колебательной энергии, а квант вибрационного возбуждения вдвое больше.
Длиной химической связи называют равновесное расстояние между двумя атомными ядрами.
Понятие энергии диссоциации для двухатомных молекул вполне однозначно. Так называют тепловой эффект реакции распада молекулы из её основного состояния на два нейтральных атома или иона.

Для многоатомных молекул оно требует уточнения.Многоатомные молекулы могут распадаться на различные фрагменты различными способами. Теплота соответствующей реакции и есть энергия диссоциации на соответствующие фрагменты. При этом сама реакция фрагментации молекулы иногда называется каналом её диссоциации. Соответственно у многоатомных молекул может быть несколько каналов диссоциации. И экспериментально, и теоретически установлено, что все наблюдаемые в природе длины разнообразных химических связей укладываются в сравнительно узкий интервал значений. Межъядерное расстояние в молекуле водорода ![]() , равное 0.74 A0, является нижней границей этого интервала. Это самая короткая химическая связь. Наибольшие значения возможных длин химических связей приближаются к 2,5-2,7 A0. Эта граница более размыта, поскольку слабые химические связи, возникающие в результате валентных взаимодействий в ряде случаев трудно отличить от водородных связей, а иногда и от связей, возникающих за счёт довольно разнообразных межмолекулярных взаимодействий. Энергии разрыва связей (энергии диссоциации) также попадают в ограниченный интервал, и его верхняя граница определяется энергией диссоциации самой прочной изо всех двухатомных гетероядерных молекул – молеклуы
, равное 0.74 A0, является нижней границей этого интервала. Это самая короткая химическая связь. Наибольшие значения возможных длин химических связей приближаются к 2,5-2,7 A0. Эта граница более размыта, поскольку слабые химические связи, возникающие в результате валентных взаимодействий в ряде случаев трудно отличить от водородных связей, а иногда и от связей, возникающих за счёт довольно разнообразных межмолекулярных взаимодействий. Энергии разрыва связей (энергии диссоциации) также попадают в ограниченный интервал, и его верхняя граница определяется энергией диссоциации самой прочной изо всех двухатомных гетероядерных молекул – молеклуы ![]() , которая равна 256 ккал/моль. Нижний предел интервала определяется примерно в
, которая равна 256 ккал/моль. Нижний предел интервала определяется примерно в ![]() ккал/моль, и он не столь однозначен. На этой нижней границе уже исчезает ясное различие между валентными и межмолекулярными взаимодействиями различных видов, хотя физическое происхождение у них одно и то же - они вызваны электрическими силами.
ккал/моль, и он не столь однозначен. На этой нижней границе уже исчезает ясное различие между валентными и межмолекулярными взаимодействиями различных видов, хотя физическое происхождение у них одно и то же - они вызваны электрическими силами.
Смотрите также
Использование альтернативных источников энергии
Во второй половине ХХ столетия перед
человечеством восстала глобальное проблема – это загрязнение окружающей среды
продуктами сгорания органического топлива. Даже если рассматривать отдельно ...
Колебательные химические реакции - как пример самоорганизации в неживой природе
...
Титан
...
