3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv
Формулировки первого закона термодинамики.
1. Общий запас энергии в изолированной системе остается постоянным.
2. Разные формы энергии переходят друг в друга в строго эквивалентных количествах.
3. Невозможно построить вечный двигатель первого рода, который бы давал механическую энергию, не затрачивая на это определенное количество молекулярной энергии.
4. Количество теплоты, подводимое к системе, расходуется на изменение U вн и совершаемую работу.
5. Uвн– функция состояния, т. е. она не зависит от пути процесса, а зависит от начального и конечного состояния системы.
Доказательство:
Пусть ТДС рассматривается при двух параметрах давления и объема, имеется два состояния системы I и II. Нужно перевести систему из состояния I в состояние II либо по пути А, либо по пути В (рис. 3). 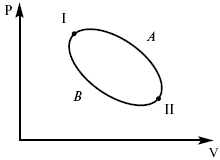
Рис. 3
Предположим, что по пути А изменение энергии будет ΔUA, а по пути В – ΔUB. Внутренняя энергия зависит от пути процесса
ΔUA = ΔUB,
ΔUA – ΔUB ≠ 0.
Согласно пункту 1 из формулировок первого закона термодинамики, общий запас энергии в изолированной системе остается постоянным
ΔUA = ΔUB ,
U вн – функция состояния не зависит от пути процесса, а зависит от состояния системы I или II. U вн – функция состояния, является полным дифференциалом
Q = ΔU + А –
интегральная форма уравнения первого закона термодинамики.
δQ = dU + δA–
для бесконечно малого процесса, δA– сумма всех элементарных работ.
Калорические коэффициенты
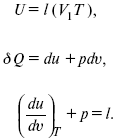
Теплота изотермического расширения: 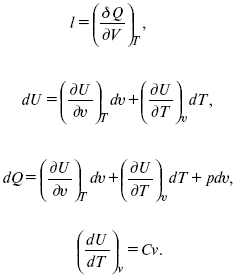
Уравнение первого закона термодинамики в калорических коэффициентах
δQ = ldv + CvdT,
где l – коэффициент изотермического расширения;
Сv– теплоемкость при постоянном объеме. 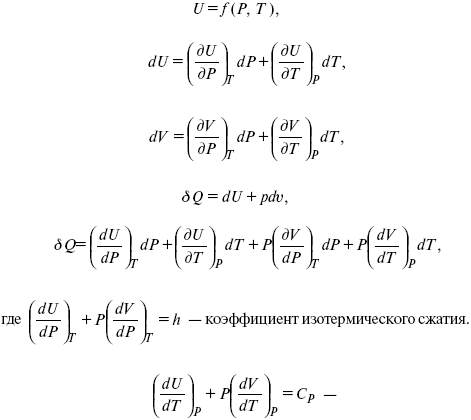
теплоемкость при const давлении,
δQ = hdp + СpdT,
δQ = χdP + ψpdv.
Связь между функциями CP и Cv
δQ = hdp + СpdT = ldv + CvdT, 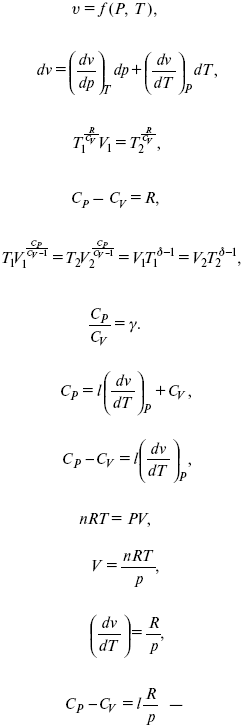
для реального газа.
Для идеального газа l= р
Ср– СV= R,
к = ( δQ/дv)ρ– теплота изохорного расширения;
m = ( δQ/дP)v– теплота изобарного сжатия.
Смотрите также
Ректификационная установка непрерывного действия для разделения 4,1 т/ч бинарной смеси ацетон - этанол
Ректификация — массообменный
процесс, который осуществляется в большинстве случаев в противоточных
колонных аппаратах с контактными элементами (насадки тарелки)
аналогичными используем ...
Галлий и его соединения
ГАЛЛИЙ, (лат. Gallium) Ga
...
Золото и его переработка
Основные свойства Начинать разговор о золоте лучше всего со свойств
этого металла и только потом переходить к тому, как эти свойства используются
человеком. Золото интересно тем, что в его х ...
