Представление о механизме окислительного декарбоксилирования арилкарбоновых кислот
Здесь близость атома кислорода к орто-положению (по отношению к карбоксильной группе) допускает нуклеофильную атаку в это положение. Ионизация связи медь-кислород увеличивает возможность такой атаки.
Некоторые авторы полагают, что процесс может проходит и по радикальному механизму:
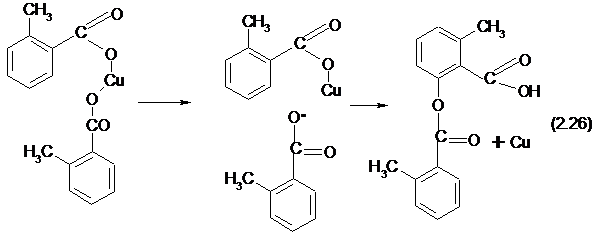 |
Однако эти представления не объясняют обязательное расположение гидроксильной группы в орто-положении по отношению к карбоксильной группе. Кроме того, ингибиторы цепных реакций, тормозящие смолообразование и некоторые другие побочные процессы, заведомо протекающие по радикальноцепному механизму, не оказывают влияния на скорость образования фенола Изложенное говорит о большей вероятности ионного механизма окислительного декарбоксилирования.
Исследования термического разложения медных солей арилкарбоновых кислот и арилсульфокислот показали, что только арилкарбоновые кислоты могут явиться реальным сырьем для синтеза фенолов. Арилсульфокислоты и диарилсульфоны дают незначительные количества фенолов (до 1-2% на превращенный исходный продукт). Однако уже при минимально необходимых для протекания реакции температурах — при 180-190 °С — идет интенсивное термическое разложение сульфокислоты с образованием коксообразного остатка и двуокиси серы. Образующийся эфир сульфокислоты и крезола (или другого фенола) значительно устойчивее к гидролизу, чем сама сульфокислота, распадающаяся на углеводород и серную кислоту. В то же время термически сложный эфир сравнительно мало устойчив.
![]() Скорость превращения медных солей арилкарбоновых кислот зависит от природы и положения имеющихся заместителей в ядре. В отсутствие воздуха и водяного пара процесс протекает по уравнению:
Скорость превращения медных солей арилкарбоновых кислот зависит от природы и положения имеющихся заместителей в ядре. В отсутствие воздуха и водяного пара процесс протекает по уравнению:
с образованием только соответствующего сложного эфира, медной соли (I) арилкарбоновой кислоты и двуокиси углерода. При этом по выходу двуокиси углерода можно с достаточной точностью судить о скорости реакции. Само термическое разложение протекает по реакции первого порядка, кинетика разложения характеризуется данными, приведенными в табл. 2.2.
Таблица 2.2.
Кинетика разложения медных солей (I) арилкарбоновой кислоты
|
Соль кислоты |
Темпе- ратура, оС |
R -10-3, мин-1 |
Соль кислоты |
Темпе- ратура, °С |
R- 10-3, мин-1 |
|
Бензойной |
234 |
0,83+0,02 |
п- Толуиловой |
234 |
2,45+0,20 |
|
240 |
2,86+0,03 |
240 |
7,74+0,12 | ||
|
250 |
4,78 +0,10 |
245 |
12,95+0,70 | ||
|
о-Толуиловой |
206 |
4,88+0,20 |
о-Хлорбензойлой |
218 |
9,42+0,22 |
|
218 |
18,01+ 0,80 |
227 |
11,97 0,10 | ||
|
м-Толуиловой |
206 |
3,72+ 0, 10 |
231 |
13,70 +0,43 | |
|
212 |
6,28+0,15 |
п-Хлорбензойной |
255 |
4,76+0,11 | |
|
218 |
12,39+0,60 |
260 |
12,29+0,22 |
Смотрите также
Энтропия органических веществ при нормальных и повышенных давлениях
...
Генеральный план. Пояснения к схеме
генерального плана.
Проектируемый цех расположен
на территории г. Казань.
Площадь для проектирования
цеха имеет ровную поверхность.
Производственные здания
расположены с учетом безопасных расстояний, санитарных ...
