Загадочная вода
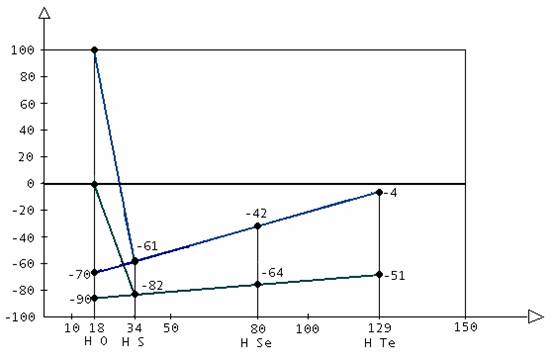 Если соединить нанесённые точки кипения Н2Те, Н2Sе, Н2S, получится почти прямая линия. Казалось бы, точка кипения воды должна лежать на её продолжении. Но она вдруг резко прыгает вверх, к 100°С. Та же странность происходит и при замерзании воды. По графику она должна была бы замерзнуть лишь при –90°С, между тем она превращается в лёд при 0°С.
Если соединить нанесённые точки кипения Н2Те, Н2Sе, Н2S, получится почти прямая линия. Казалось бы, точка кипения воды должна лежать на её продолжении. Но она вдруг резко прыгает вверх, к 100°С. Та же странность происходит и при замерзании воды. По графику она должна была бы замерзнуть лишь при –90°С, между тем она превращается в лёд при 0°С.
Разве может вода не подчинятся общим для других веществ физико-химическим законам? Значит, в мире молекул действуют какие-то неизвестные, а может быть, и не правильно понятые силы?
Объяснить, почему вода кипит при 100°С, а замерзает при 0°С, удалось лишь около 70 лет тому назад. Дело в том, что одна сторона их имеет положительный заряд, а другая – отрицательный. Про такие молекуле говорят, что они полярны. Полярность молекул вызвана тем, что атомы водорода присоединяются к атому кисло –рода не симметрично с боков, а в молекуле сероводорода или теллуристого водорода, а тяготеют к одной стороне.
Как только водород соединится с кислородом, тот час орбиты его электронов меняются, отклоняясь к кислороду. Ведь электроны водорода принадлежат теперь не ему одному, они стали общим достоянием водорода и кислорода. Но из-за изменения орбиты электронов ядра водорода, обладающие положительным зарядом, обнажаются. В целом молекула воды, конечно, остаётся нейтральной. Но та сторона её, где присоединился водород, оказывается положительной по заряду, а та, куда сдвинулись электроны, - отрицательна.
Из-за того, что молекулы воды полярны, между ними кроме обычных сил притяжения действуют ещё и электрические. Они получили названия водородных связей. Одна молекула воды может удержать ими возле себя целых 4 молекулы. Вот почему вода кипит не при –70°С, а при 100°С, и замерзает при температуре на 90° выше, чем ей полагалось бы.
Водородные связи делают воду чудесной, непохожей ни на какую другую, жидкость. Количество тепла, нужное для нагревания одного грамма её на один градус, иными словами теплоёмкость, в два раза больше, чем теплоёмкость спирта, в 30 – чем ртути. Способность воды запасать в себе, словно печка, большие количества тепла, а затем отдавать его обратно имеет огромное значение для жизни Земли. В тех местах, где её поблизости нет, разница между ночной и дневной температурами достигает 50°. При таком перепаде температур лопаются камни! В знойной Сахаре после испепе –ляющей жары, ночью без костра можно замёрзнуть! Оберегая растения от заморозков, садовники ставили в неотапливаемых оранжереях бочки с водой. Остывая на 10°, бочка давала столько же тепла, сколько небольшая охапка дров.
Для того чтобы нагреть 1 литр воды от 0° до 100°, надо затратить 100 кило калорий. Для того чтобы испарить тот же литр, - в 5 раз больше. Вот почему так холодно в мокром костюме. Удивительные свойства воды неисчислимы. Она вовсе не такая мягкая и под –датливая, как кажется. Об неё можно больно ушибится если неудачно нырнёшь. Столкновение дождинки с реактивным самолётом оставляет след на его корпусе. В США есть токарный станок, где вода режет бетон. Кажется невероятным, но вода прочна, как сталь.
Вода универсальный растворитель. В природе нет, ни одного вещества, которое бы не растворялось в тех или иных количествах. Тончайшие аналитические весы показали бы, что вместе со стаканом чая вы каждый день выпиваете 0,0001 грамма растворённого стекла.
Смотрите также
Расчет сметной стоимости проектируемого объекта
Капитальные
вложения в проектируемый объект принято называть полной сметной стоимостью
этого объекта. В проектных организациях расчет капитальных затрат
осуществляется путем составления локальных с ...
Биологически активные добавки
...
Химия в решении сырьевой проблемы
В наши дни, когда
человеческое развитие достигло высот, такие проблемы, как экология,
продовольствие, энергия заставляют задуматься о будующем.
Как мне кажется, эта
тема наиболее актуа ...
