Азот.
В аммиачной воде наибольшая часть аммиака содержится в виде молекул NH3, равновесие смещено в сторону образования аммиака, поэтому она пахнет аммиаком. Тем не менее водный раствор аммиака по традиции обозначают формулой NH4OH и называют гидроксидом аммония, а щелочную реакцию раствора аммиака объясняют как результат диссоциации молекул NH4OH:
![]()
![]() NH4OH NH4+ + OH—
NH4OH NH4+ + OH—
А так как в растворе аммиака в воде концентрация гидроксид – ионов невелика, то гидроксид аммония относится к слабым основаниям.
Аммиак сгорает в кислороде и в воздухе (предварительно подогретом) с образованием азота и воды:
4NH3 + 3O2 = 2N2 + 6H2O
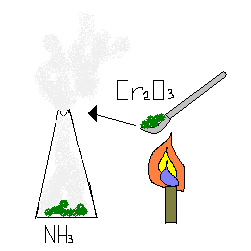
В присутствии катализатора [например, оксида хрома (III )] реакция протекает с образованием оксида азота (II) и воды:
Cr2O3
4NH3 + 5O2 = 4NO + 6H2O
Аммиак взаимодействует с галогенами, при этом выделяется азот и водородное соединение галогена:
2NH3 + 3Br2 = 6HBr + N2
2NH3 + 3Cl2 = 6HCl + N2
Аммиак – сильный восстановитель. При нагревании он восстанавливает оксид меди (II), а сам окисляется до свободного азота:
3Cu+2O + 2N—3H3 = 3Cu0 + N20 + 3H2O
2N—3 – 6e = N2 1
Cu2+ + 2e = Cu 3
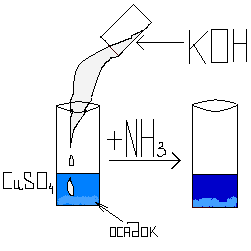
Аммиак взаимодействует с перманганатом калия:
NH3 + KMnO4 = N2 + H2O + MnO2 +KOH
Добавление аммиака изменяет цвет раствора:
Важным химическим свойством аммиака является его взаимодействие с кислотами с образованием солей аммония. В этом случае к молекуле аммиака присоединяется ион водорода кислоты, образуя ион аммония, входящей в состав соли:
H
![]()
![]() NH3 + H+Cl-- [H N H]Cl
NH3 + H+Cl-- [H N H]Cl
H
Связь между ионами NH4 и Cl ионная, в ионе NH4 четыре связи ковалентные, причём три из них полярные и одна по донорно – акцепторном механизму.
Смотрите также
Серебро. Общая характеристика
СЕРЕБРО Ag
Базовые характеристики
Порядковый номер
47
Атомный вес
107,870 у.е.
Валентность
I, ...
ПО Маяк
...
