Гомогенный катализ
Катализ - явление разностороннее, и даже сама среда -растворитель может принци-пиально изменить механизм реакции, оказывая решающее влияние на её скорость а, значит, играть роль катализатора. Его основными видами в растворе считают катализ: кислотный, металлокомплексный, ферментный.
Внешне наиболее прост для теоретического моделирования кислотный катализ. Намного разноообразнее варианты металлокомплексного катализа. С ферментным катализом связана вся химия живых организмов. Он не имеет равных в части ускорения реакций – ферментно-катализиру-емые процессы могут ускоряться в десятки миллионов раз. Ферменты это биокатализаторы-белки.
Основные положения теории гомогенного катализа по Шпитальскому: (изложено по книге Ерёмина – научная школа МГУ):
Катализатор - вещество переводящее систему реагентов в реакционноспособное состояние путём образования с реагентами лабильного каталитического комплекса.
2) Образование комплекса - относительно быстрый квазиравновесный процесс.
3) Лабильный каталитический комплекс продукт необратимо и относительно медленно изменяется .
Общая скорость реакции пропорциональна концентрации промежуточного каталитического комплекса, но не концентрации реагента. Непосредственная пропорциональная связь между скоростью и концентрацией реагента является следствием сложного механизма процесса.
В зависимости от значения константы равновесия на стадии образования промежуточного продукта определённая доля катализатора находится в системе в свободном состоянии.
В образовании промежуточных продуктов могут одновременно принимать участие многие вещества, так что многие катализаторы, приводящие к одному общему промежуточному продукту, будут действовать как один смешанный катализатор.
Помимо катализатора в образовании промежуточных продуктов могут участвовать «сопутствующие вещества (лучше сказать частицы) », главным образом ионы H+ и OH- . (Текст в ред. Ерёмина, стр. 308).
«Сопутствующие вещества» помимо участия в образовании промежуточных продуктов могут влиять на степень лабильности промежуточного продукта, и, следовательно, на скорость его разложения даже без участия в процессе его обратимого образования.
Один и тот же катализатор может образовать с реагирующим веществом многие промежуточные продукты.
При одновременном действии многих катализаторов (пункт 6) как и при образовании многих промежуточных продуктов из одного катализатора (пункт 9) результирующая скорость реакции равна сумме скоростей реакции разложения отдельных промежуточных продуктов.
И для большей полноты см. книгу Ерёмина !!!.
Общая кинетическая схема гомогенного катализа. (см. книгу Ерёмина)
Сравнение маршрутов превращения:
![]() (11.1)
(11.1)
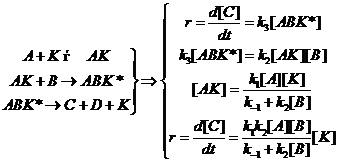 (11.2)
(11.2)
Различают два предельных случая гомогенного катализа, в зависимости от типа образующегося каталитического комплекса.
Каталитические комплексы бывают двух типов, а именно: 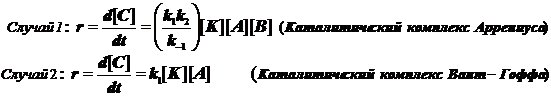 (11.3)
(11.3)
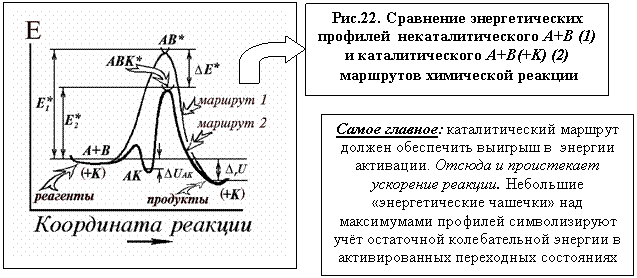
Энергетические профили некаталитического (1) и каталитического (2) маршрутов химической реакции совмещены на рисунке. Верхняя кривая отвечает некаталитическому протеканию процесса, нижняя с двумя максимумами соответствует механизму реакции в присутствие катализатора (на самом деле вдоль оси ординат обе кривые раздвинуты на величину энергии катализатора).
 |
Смотрите также
Алюминий и его свойства
Алюминий - химический элемент третей группы
периодической системы Д.И. Менделеева.
Плотность, (кг/м3)
2,7
Температура плавления Тпл,
° С
...
Способы получения синтез-газа из угля
Газификация —
высокотемпературный процесс взаимодействия углерода топлива с окислителями,
проводимый с целью получения горючих газов (Н2, СО, СН4).
Первым способом получения синтез-газа был ...
