Комплексные соединения. Основные типы и номенклатура, структура и свойства.
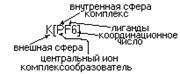
В зависимости от заряда разл. анионные комплексы: [PF6]-, [Zn(CN)6]-4, [Al(OH)4]-; катионные комплексы [Cu(NH3)4]2+, [Ni(H2O)4]2+; и нейтральные комплексы: [Pt(NH3)4Cl2]. Заряд комплекса численно равен алгебраической сумме заряда центрального иона и заряда лиганда. Пр.: [Zn(CN)4], Z=ZZn2++4ZCN-=2+4*(-1)=-2 Комплексообразователем служат атомы или ионы имеющие вакантные орбитали. К наиболее распространенным комплексообразователям относятся d-элементы 7, 8, 1, 2 – подгрупп.
Лиганды – к ним относят простые анионы F-,Cl-, I- или нейтральные молекулы NH3, H2O, CO, H2, NCH2, CH2, NH2; сложные анионы: CN-, CNS-. Ионы или отдельные атомы ионов и молекул легандов имеют неподеленые пары электронов.
Смотрите также
Что такое природный газ?
Еще три
века назад слова “газ” не существовало. Его впервые ввел в XVII веке голландский ученый Ван-Гельмонт. Оно определяло вещество, в
отличии от твердых и жидких тел способное ...
