Приведение элементов в порядок
В 1864 г. английский химик Джон Александер Рейна Ньюлендс (1837—1898) расположил известные элементы в порядке возрастания атомных весов. Составив такой список элементов, он обнаружил, что в полученном ряду можно выявить определенную закономерность в изменении свойств элементов (рис. 13). Когда Ньюлендс расположил элементы вертикальными столбцами по семь элементов в столбце, то выяснилось, что сходные элементы, как правило, попадают в одни и те же горизонтальные ряды. Так, калий располагается вслед за очень похожим на него натрием, селен располагается в одном ряду с похожей на него серой, кальций — рядом с похожим на него магнием и т. д. Действительно, в соответствующем ряду можно было найти каждую из трех триад Дёберейнера. 
Рис. 13. «Закон октав» Ньюлендса (1864 г.).
Ньюлендс назвал открытую им закономерность законом октав , так как каждый восьмой элемент обладал свойствами, сходными с первым, девятый — со вторым и т. д.
(В музыкальной октаве семь нот, восьмая нота начинает новую октаву.) К сожалению, помимо рядов, содержащих сходные элементы, в таблице были ряды с совершенно непохожими элементами. Поэтому другие химики сочли такое совпадение случайным и отнеслись к открытию Ньюлендса как к не заслуживающему внимания факту. Ньюлендсу не удалось даже опубликовать свою работу.
Двумя годами раньше французский геолог Александр Эмиль Бегюйе де Шанкуртуа (1820—1886) также расположил элементы в порядке возрастания атомных весов и отметил их на так называемом «винтовом» графике. И в этом случае наблюдалась та же тенденция: сходные элементы попадали в вертикальные столбцы. Публикуя свое сообщение, Шанкуртуа не сопроводил его построенным им графиком, и его работа также осталась незамеченной (рис. 14). 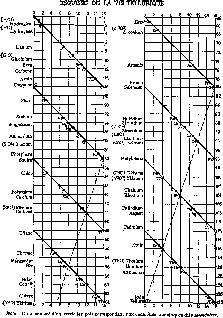
Рис. 14. «Винтовой график» Бегуйе де Шанкуртуа (1862 г.) Расположив элементы в порядке возрастания их атомных весов, ученый соединил линиями элементы с похожими свойствами.
Более удачливым оказался немецкий химик Юлиус Лотар Мейер (1830—1895). Мейер рассматривал объемы, занимаемые весовыми количествами элемента, численно равными их атомным весам. При этом выяснилось, что в каждом таком весовом количестве любого элемента содержится одно и то же число атомов. Это означало, что отношение рассматриваемых объемов различных атомов равнялось отношению объемов отдельных атомов этих элементов [70]. Поэтому указанная характеристика элемента получила название атомный объем .
Графически зависимость атомных объемов элементов от их атомных весов выражается в виде ряда волн, поднимающихся острыми пиками в точках, соответствующих щелочным металлам (натрию, калию, рубидию и цезию). Каждый спуск и подъем к пику соответствует периоду в таблице элементов. В каждом периоде значения некоторых физических характеристик, помимо атомного объема, также закономерно сначала уменьшаются, а затем возрастают (рис. 15). 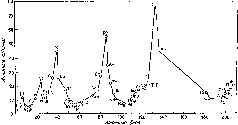
Рис. 15. График Мейера (кривая атомных объемов элементов).
Водород — элемент с наименьшим атомным весом — стоял в списке элементов первым. В то время принято было считать, что первый период включает лишь один элемент. (В современных таблицах первый период включает два элемента — водород и гелий.) Второй и третий периоды графика Мейера включали каждый по семь элементов, эти периоды дублировали октавы Ньюлендса. Однако в следующих двух периодах число элементов превышало семь. Таким образом Мейер показал, в чем ошибка Ньюлендса. Закон октав не мог строго выполняться для всего списка элементов, последние периоды должны были быть длиннее первых.
Мейер опубликовал свою работу в 1870 г. Годом раньше русский химик Дмитрий Иванович Менделеев (1834—1907) установил порядок изменения длины периодов элементов и наглядно продемонстрировал значение своего открытия [71].
Менделеев выполнял свою диссертационную работу в Германии, в Гейдельберге, как раз во время Международного химического конгресса в Карлсруэ. Он присутствовал на конгрессе и слышал речь Канниццаро, в которой тот четко изложил свою точку зрения на проблему атомного веса. Вернувшись в Россию, Менделеев приступил к изучению списка элементов и обратил внимание на периодичность изменения валентности у элементов, расположенных в порядке возрастания атомных весов: валентность водорода 1, лития 1, бериллия 2, бора 3, углерода 4, магния 2, азота 3, серы 2, фтора 1, натрия 1, алюминия 3, кремния 4, фосфора 3, кислорода 2, хлора 1 и т. д.
Смотрите также
Колебательные спекторы бета-дикетонатов палладия (II) и их интерпретация
...
Сущность окислительно-восстановительных реакций
...
Металлы и сплавы в химии и технике
Химические
элементы – это элементы образующие в свободном состоянии простые вещества с
металлической связью. Из 110 известных химических элементов 88-металлы и только
22-неметаллы.
Такие ...
