Основы структурной теории цветности органических молекул
Попытки связать цвет органического вещества с его структурой предпринимаются исключительно давно. Примерно сто лет назад была выдвинута порвал теория, соединившая окраску с наличием в молекуле соединений определенных групп атомов.
Особое значение для структуры окрашенного соединения имеет цепочка атомов С, связанных друг с другом чередующимися двойными и одинарными связями:
-СН=СН-СН=СН- и т. д.
В таких цепочках проявляется эффект сопряжения. Происходит как бы выравнивание двойных и одинарных связей:
![]()
Перекрывание орбиталей, на которых находятся π-электроны, таково, что появляется возможность образования как бы дополнительной связи и между теми углеродными атомами, которые соединены одинарной связью; все атомы охватываются едиными молекулярными орбиталями. Электрон получает возможность передвигаться по всей молекуле в целом.
С подобным эффектом сопряжения мы встречаемся при изучении свойств бензола, у которого невозможно различить отдельные двойные и одинарные связи; да их в молекуле СбНб и нет — все связи равноценные (рис. 12).
Однако образование таких делокализованных л-связей накладывает ограничение на строение молекулы: чтобы электронные орбитали могли перекрываться, атомы в молекуле должны лежать хотя бы примерно в одной плоскости.
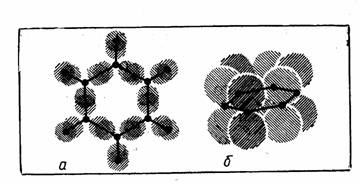
Рис. 12. Электронное строение молекулы бензола: а — σ-связи; б — π--связи.
Опытным путем еще до того, как были открыты закономерности электронного строения и его изменение при взаимодействии молекулы вещества с лучом света, удалось подметить наиболее важное по влиянии структурных фрагментов молоекул па цвет соединений. Так оказалось, что удлинение цепи сопряженных двойных связей приводит к переходу от бесцветного или слабоокрашенного к темным цветам:
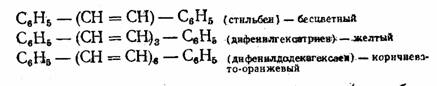
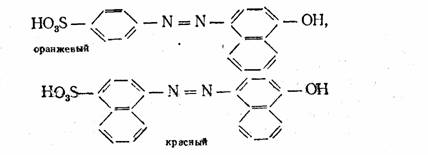
Если вместо простых ароматических ядер (типа бензольных) появляются конденсированные (типа нафталина), то это вызывает углубление цвета,
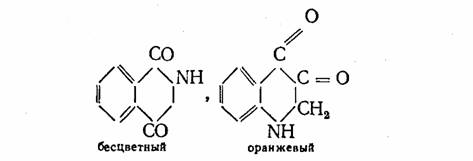
Группы С = О, связанные друг с другом, вызывают более глубокий цвет соединения:
Более прочная и более тесная связь между атомами углерода, относящимися к отдельным частям молекулы, приводит к более интенсивной и более глубокой окраске:
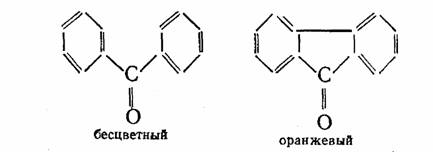
Кроме цепей сопряжения, ответственными за цвет являются и другие группы атомов, между которыми тоже имеются ненасыщенные связи. Такие группы, благодаря которым возникает возможность появления цвета у вещества, получили название хромофоры от греческих слов «хрома» — цвет и «форео» — несу, иначе говоря — «несущие цвет». Вот примеры нескольких таких групп:
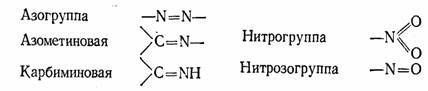
Вещества, содержащие хромофоры, называются хромогенами. Сами по себе эти вещества еще не являются красителями, потому что не отличаются ни яркостью, ни чистотой цвета. Объясняется это тем, что хотя и происходит в таких молекулах перераспределение электронов и их энергии, но не настолько, чтобы избирательно и в значительном количестве поглощать кванты света только одной определенной длины волны. Такая возможность появляется лишь после того, как в молекулу соединения будут введены группы, отличающиеся либо резко выраженным сродством к электрону, либо способные свои электроны в значительной мере отдавать в общее пользование. Одним словом, такие группы, которые резко меняют состояние электронов в хромофорных группировках.
Группы, усиливающие окраску веществ, называются ауксохромы (от греческого слово «ауксо» — увеличиваю). Существует два типа таких групп:
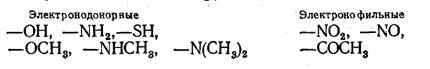
Только после введения ауксохромов цвет соединения становится чистым (начинается избирательное поглощение лучей определенной длины волны) и достаточно интенсивным (падающий свет легко сдвигает электроны в молекуле). Наибольший эффект достигается, когда в молекуле соединения присутствуют одновременно и электронодонорные и электронофильные группы атомов. Одни из них отдают, а другие соответственно притягивают электроны общей электронной системы молекулы.
Итак, из структурных особенностей органических молекул для появления цвета у вещества имеют значение следующие: 1) цепочка из чередующихся одинарных и двойных связей (при этом в такой цепочке могут участвовать и двойные связи не только между углеродными атомами) ; 2) наличие групп или атомов, сильно притягивающих или, наоборот, легко отдающих свои электроны в общую электронную систему молекул; 3) атомы в молекуле должны лежать в одной плоскости (или весьма близко к этому состоянию).
Все это подчинено одной цели — легкости воздействия квантов видимого света на электронную систему молекул и перевод ее в возбужденное состояние.
