Соединения Pt (II)
Для Pt (II) типичны диамагнитные плоскоквадратные комплексы, что объясняется значительной величиной параметра расщепления D, как у любого d-элемента 5-го и 6-го периодов.
При большом значении D в октаэдрическом комплексе два электрона оказываются на сильно разрыхляющих молекулярных s*d-орбиталях. Поэтому энергетически выгодней становится потеря этих электронов и переход Pt (II) в степень окисления +4 либо перерождение октаэдрического комплекса в плоскоквадратный. Распределение восьми электронов на орбиталях плоскоквадратного комплекса оказывается энергетически выгоднее, чем на молекулярных орбиталях октаэдрического комплекса. Сосредоточение восьми электронов на четырех молекулярных орбиталях определяет диамагнетизм комплексов плоскоквадратного строения.
Соединения Pt (II) интенсивно окрашены. Структурной единицей соединений Pt (II) является квадрат. Так, в кристаллах PtO (рис. 1) атомы Pt окружены четырьмя атомами кислорода по вершинам четырехугольника. Эти квадраты соединены сторонами в цепи, которые перекрещиваются под углом 90°. Аналогично построены кристаллы PtS.
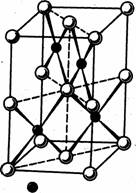 Рис. 1. Структура PtO и PtS
Рис. 1. Структура PtO и PtS
Дихлорид платины имеет совершенно другое строение. Красно-черные кристаллы PtCl2 состоят из октаэдрических кластерных группировок Pt6Cl12.
Хлориды платины могут быть получены прямым синтезом:
Pt + Cl2 = PtCl2 (t = 500 0C)
Pt + 2Cl2 = PtCl4 (t = 250 0C)
Дихлорид PtCl2 можно получить и диссоциацией PtCl4, а также нагреванием платинохлористоводородной кислоты:
(Н3О)2РtCl6*nH2O = PtCl2 + НС1 + (n + 2)Н2О + Cl2 (t > 300 0C)
Генетическую связь безводных хлоридов платины передает следующая схема:
370 °C 475 °C 581 °C 583 °C
PtCl4 è РtC13 è PtCl2 è PtCl è Pt
Обращает на себя внимание очень малая величина температурного интервала, разделяющего области существования хлоридов платины различного состава. Это одно из специфических свойств соединений Pt, имеющих в своей основе высококовалентную кинетически инертную химическую связь.
Оксиды и гидроксиды Pt (II) черного цвета, в воде не растворяются; PtO устойчив также по отношению к кислотам. PtS в кислотах не растворяется.
Из катионных комплексов Pt (II) очень устойчивы и легко образуются амминокомплексы [Pt(NH3)4]2+
PtCl2 + 4NH3 = [Pt(NH3)4]Cl2
Известно также большое число производных катионных комплексов Pt (II) с органическими лигандами. Еще более устойчивы тетрацианидоплатинат (II) [Pt(CN)4]2--иoны (для последнего b4=1*1041). Известен также H2[Pt(CN)4]*3H2O; в водных растворах —это двухосновная сильная кислота (называемая платиносинеродистой).
Платинаты (II) очень многообразны и устойчивы. Например, комплексные галогенйды Pt (II) характеризуются следующими константами устойчивости:
Ион . [PtCl4]2- [PtBr4]2- [PtI4]2-
lg b 16,0 20,5 -30
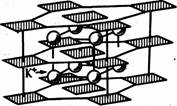 Рис 2. Структура K2[PtCl4]
Рис 2. Структура K2[PtCl4]
Соли М2[PtС14] (красного цвета) образуются при взаимодействии соединений Pt (II) в соляной кислоте с соответствующими солями щелочных металлов. Наиболее важны растворимые в воде K2[PtCl4] и Na2[PtCl4] (рис. 2), являющиеся исходными веществами для синтеза различных соединений платины.
Известны также соединения, в которых Pt (II) входят одновременно в состав и катиона, и аниона, например [Рt(NН3)4][РtСl4]. Это соединение (зеленого цвета) осаждается при смешении растворов [Рt(NН3)4]Сl2 и
K2[PtCl4]:
[Pt(NH3)4]Cl2 + K2[PtCl4] = [Pt(NH3)4][PtCl4] + 2KC1
Наряду с катионными и анионными комплексами весьма разнообразны нейтральные комплексы Pt (II) типа [Pt(NH3)2Х2] (где Х = С1-, Вг-, NO2-). Для соединений этого типа характерна геометрическая (цис-транс) изомерия. Например, составу [Рt(NН3)4С12] отвечают два соединения, которые отличаются свойствами, в частности окраской: цис-изомер — оранжево-желтый, транс-изоиер — светло-желтый. Цис- и транс-изомеры всегда имеют несколько (а иногда и сильно) различающуюся растворимость в воде, кислотах, а также кинетические и термодинамические характеристики.
В отличие от транс-изомера, цис-изомер обладает ярко выраженной противораковой физиологической активностью. Существенно различны и способы получения этих изомеров. Цис-изомер образуется при замещении двух хлорид-ионов молекулами аммиака в тетрахлороплатинат (II)-комплексе:
K2[PtCl4] + 2NH3 = [Pt(NH3)2Cl2] + 2КС1
циc-изомер
Транc-изомер получается при замещении двух молекул аммиака на хлорид-ионы в комплексе тетрааммин-платина (II):
[Pt(NH3)4]Cl2 +2HC1 = [Pt(NH3)2Cl2] + 2NH4C1
транс-изомер
Для понимания направления течения реакций замещения лигандов в комплексах важное значение имеет принцип транс-влияния («Поведение комплексов зависит от трансзаместителей»), установленный И. И. Черняевым (1926). Согласно этому принципу некоторые лиганды облегчают замещение лигандов, находящихся с ними в транс-положении. Таким образом, при синтезе соединений платины играет важную роль не только природа реагентов, но и порядок их смешения, временные и концентрационные соотношения: в зависимости от условий синтеза могут быть получены изомеры положения.
Смотрите также
Биогенные амины и алкалоиды
К
пищевым заболеваниям относятся заболевания людей, возникающие при потреблении
продуктов питания с наличием в них опасных для человека микроорганизмов или
ядовитых веществ. Пищевые отравле ...
Познавательная викторина по химии Угадай химический элемент
...
Структура процесса обслуживания официантами
Метод обслуживания официантами применяется в ресторанах, кафе и закусочных первой и высшей категории, а также в некоторых столовых. Структура процесса обслуживания официантами состоит из двух стадий: ...
