Сульфирование ароматических соединений серной кислотой и олеумом
Поскольку в процессе старения моторного масла доля ароматических соединений возрастает, целесообразно рассматривать процесс сульфирования на их примере.
Сульфирование ароматических соединений является реакцией электрофильного замещения и в среде концентрированной серной кислоты обычно протекает по схеме:
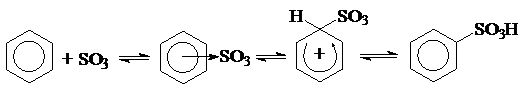
Существенным отличием этой реакции от других реакций электрофильного замещения является ее обратимость. (Следует отметить, что в отсутствие воды обратимость практически не проявляется, так как константы скорости обратных реакций на 5-6 порядков ниже констант скоростей реакций, ведущих к образованию целевых продуктов).
В связи с рассмотрением вопроса о механизме сульфирования необходимо обсудить строение и основные свойства как серной кислоты, так и олеума.
Безводная серная кислота при комнатной температуре представляет собой в сильной мере ассоциированное соединение с длинными образованными за счет водородных связей, цепевидными молекулами:
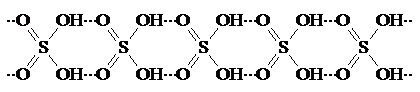
При повышении температуры эти цепочки разрушаются.
При растворении SO3 в концентрированной серной кислоте образуется целая серия полимерных кислот:
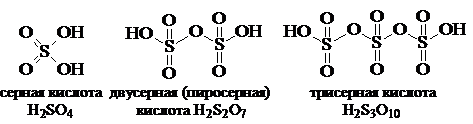
и т.д.
Смесь H2SO4, H2S2O7, H2S3O10, H2S4O13 - густая маслянистая, дымящая на воздухе жидкость, - называется олеумом. Пары над олеумом состоят главным образом из SO3, а в парах над серной кислотой SO3 почти нет. Необходимо учитывать, что концентрированная H2SO4 является довольно сильным окислителем, особенно при нагревании. Сама концентрированная H2SO4 не способна сульфировать органические соединения. Это, в частности, доказывается тем, что при добавлении сульфата натрия к серной кислоте скорость сульфирования резко падает и при увеличении концентрации сульфата процесс останавливается, так как всякая диссоциация H2SO4 подавляется и сульфирующие частицы образоваться не могут.
Н.Н.Ворожцов и К.К.Ингольд полагали, что сульфирующими агентами являются поляризованные молекулы SO3 и S2O6, а также катионы НSO3Å и Н3SO4Å:
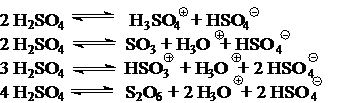
Б.В.Пассет с сотрудниками впервые применил для исследования механизма и кинетики сульфирования помимо традиционных химических и физико-химических методов математическое моделирование процесса на ЭВМ. Проведенные исследования подтвердили правильность точки зрения К.Ингольда о том, что основным сульфирующим реагентом является поляризованная молекула SO3. Механизм сульфирования НSO3Å следует, по-видимому, рассматривать как кислотно-катализируемое сульфирование SO3.
![]()
Для промышленного сульфирования серной кислотой чаще всего используют 92-93%-ную серную кислоту (купоросное масло) и 98-100%-ную серную кислоту (моногидрат).
Незамещенные ароматические углеводороды сульфируют серной кислотой при нагревании. При сульфировании замещенных аренов электродонорные заместители облегчают прохождение реакции, а электроноакцепторные - затрудняют. Поэтому процесс получения ди- и трисульфокислот обычно ведут в две стадии. Сначала в относительно мягких условиях вводят одну сульфогруппу, а затем, не выделяя моносульфокислоту из реакционной массы, в жестких условиях (олеум, высокая температура) вводят вторую сульфогруппу.
При сульфировании малоактивных субстратов используют олеум (обычно 20-25%-ный или 60-65%-ный) [12].
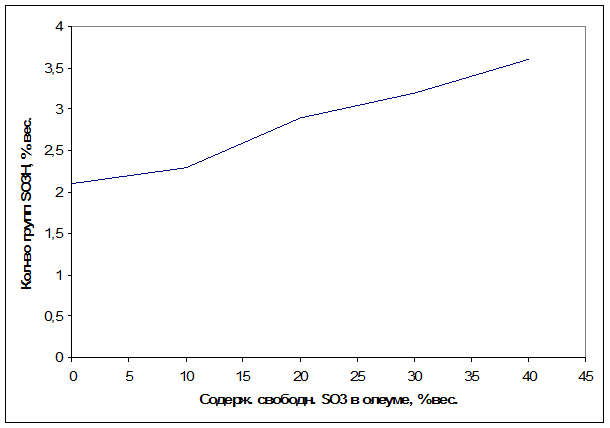
Рис.1.1 Зависимость содержания сульфогрупп от концентрации олеума при сульфировании масел [13].
Сульфирование начинается обычно как гетерогенный процесс. Спустя непродолжительное время после начала реакции масса гомогенизируется, и основное время процесс протекает как гомогенный.
Реакция десульфирования протекает при повышенных температурах при наличии в реакционной массе воды и катализируется кислотами.
Концентрация серной кислоты оказывает решающее влияние на ход процесса сульфирования. По мере прохождения сульфирования концентрация серной кислоты вследствие разбавления ее реакционной водой падает:
![]()
С уменьшением концентрации серной кислоты скорость сульфирования резко снижается вследствие кислотной диссоциации в соответствии с уравнением:
![]()
и резким уменьшением концентрации сульфирующих реагентов (SO3, HSO3Å). Между тем, концентрация сульфирующих частиц даже в 100%-ной H2SO4 невысока и составляет доли процента.
Смотрите также
Роль химии в решении сырьевой, энергетической и экологической проблемах
В наши дни, когда
человеческое развитие достигло высот, такие проблемы, как экология,
продовольствие, энергия заставляют задуматься о будующем.
Как мне кажется, эта
тема наиболее актуа ...
Элементарные стадии с участием координационных и металлоорганических соединений в растворах и на поверхности металлов и оксидов
Элементарные стадии органических реакций,
катализируемых кислотами, основаниями, нуклеофильными катализаторами,
комплексами металлов, твердыми металлами и их соединениями в газофазных или
ж ...
